今日头条
葆正引进GnRHR拮抗剂上Ⅲ期临床。上海葆正医药从Kissei公司引进的GnRH拮抗剂BG2109(linzagolix),在中国绝经前女性子宫内膜异位症相关疼痛患者中开展的Ⅲ期临床完成首例患者入组。Linzagolix可直接与垂体GnRHR竞争性结合,减少卵巢的雌激素生成。2022年6月,linzagolix(商品名Yselty)已在欧盟及英国获批上市,单用或联合雌孕激素反向添加治疗(ABT),用于治疗育龄妇女子宫肌瘤中重度症状。
国内药讯
1.德琪XPO1抑制剂获批香港上市。中国香港特别行政区政府卫生署批准德琪医药新型口服选择性核输出蛋白(XPO1)抑制剂希维奥(塞利尼索,Xpovio)上市,联合地塞米松治疗至少经四种治疗且对至少两种蛋白酶体抑制剂(PI)、两种免疫调节剂(IMiD)和一种抗CD38单抗难治的复发/难治性多发性骨髓瘤(R/R MM)患者。德琪医药拥有该新药在包括大中华区、韩国等多个亚太市场的独家权利。
2.信达PCSK9单抗降脂Ⅲ期成果见刊。信达生物PCSK9单抗托莱西单抗(IBI306)治疗中国高胆固醇血症患者的Ⅲ期CREDIT-4研究在线发表在期刊JACC上。与安慰剂相比,IBI306(450mg Q4W)治疗12周时显著降低患者LDL-C水平(68.9%vs5.8%)和Lp(a)水平(45.4%vs11.5%);IBI306还能显著降低非高密度脂蛋白胆固醇(non-HDL-C)和载脂蛋白B(ApoB)的水平;药物总体安全性与已知研究一致。目前,托莱西单抗正接受NMPA的监管审查。
3.药捷安康胆管癌新药拟纳入突破性疗法。药捷安康1类化药TT-00420片(Tinengotinib)获CDE拟纳入突破性治疗品种,用于既往系统性化疗以及FGFR抑制剂治疗失败或复发的、不可切除的晚期或转移性胆管癌(CCA)。Tinengotinib是一款新型激酶谱选择性抑制剂,通过靶向肿瘤细胞和改善肿瘤微环境发挥抗肿瘤作用。在美国,FDA已授予该产品用于治疗CCA的孤儿药认证及快速通道资格。
4.恒瑞PD-L1单抗联合HER3-ADC获批临床。恒瑞医药PD-L1单抗阿得贝利单抗注射液获国家药监局临床试验默示许可,拟联合SHR-A2009加或不加化疗用于晚期实体瘤患者的治疗。今年2月,该新药已获得NMPA批准上市,用于联合化疗一线治疗广泛期小细胞肺癌。SHR-A2009是恒瑞自主研发、靶向HER3的抗体偶联药物(ADC),目前正在Ⅰ期临床开发阶段。
5.天港医诺CD3/TAA双抗国内报IND。天港医诺1类生物制品注射用TGI-6的临床试验申请获CDE受理。TGI-6可同时特异性结合肿瘤细胞表面的肿瘤相关抗原和T细胞表面的CD3分子,强烈活化T细胞并杀伤肿瘤细胞。该产品拟开发用于治疗结直肠癌及其它肿瘤相关抗原阳性实体瘤。今年6月,该新药已在美国获批开展Ⅰ期临床试验。
6.北京锤特溶瘤腺病毒报IND。北京锤特生物1类生物制品重组人nsIL12溶瘤腺病毒注射液(BioTTT001)的临床试验申请获CDE受理。BioTTT001可诱导机体产生肿瘤治疗性疫苗作用,在杀伤远处转移肿瘤细胞的同时抑制肿瘤复发的可能,达到治疗肿瘤、预防肿瘤复发和转移的效果。临床前研究显示,BioTTT001对各种人实体瘤细胞系均具有较强的杀伤能力,提示BioTTT001体外抗肿瘤能力良好。
国际药讯
1.帕金森病DBS创新软件获FDA批准。波士顿科学(Boston Scientific)Vercise神经导航5软件已获得FDA批准,作为Vercise Genus脑神经刺激(DBS)系统的一部分,为临床医生在治疗帕金森病或特发性震颤患者时提供治疗依据。这些软件工具能提供每个人独特大脑解剖结构的实时可视化、实时刺激。此前,Vercise Genus DBS系统已获FDA批准用于治疗帕金森病相关的运动症状。在中国,该系统已被纳入创新医疗器械特别审查程序。
2.创新NOX 1/4抑制剂Ⅱ期临床积极。Calliditas公司NOX 1/4抑制剂setanaxib在治疗头颈部鳞状细胞癌(SCCHN)的概念验证Ⅱ期临床中期结果积极。在16例可评估患者中,有7例患者达到疾病稳定或部分缓解(其中6例在setanaxib组,1例在安慰剂组)。数据显示setanaxib展现积极无进展生存期(PFS)结果,并支持setanaxib的抗纤维化作用(即特发性肺纤维化信号途径和肝纤维化/肝星状细胞活化途径)方式。
3.创新抗氧化诱导剂获突破性疗法认定。Renibus公司针对Nrf2、IL-10和铁蛋白(ferritin)的强效诱导剂RBT-1获FDA授予突破性疗法认定,以降低接受心胸外科手术患者发生术后并发症的风险。RBT-1可诱导细胞保护性预适应(preconditioning)生物标志物(主要来自Nrf2通路)上调,已在Ⅱ期临床中达到其生物标志物主要终点,以及几个关键的临床结局终点,支持RBT-1可改善心胸外科手术后结局的潜力。
4.BCMA/CD38/CD3三抗获孤儿药认定。Ichnos Sciences公司BCMA/CD38/CD3三特异性抗体ISB 2001获FDA授予孤儿药认定,用于治疗多发性骨髓瘤患者。ISB 2001结合三个专有的Fab臂,T细胞上的CD3,以及多发性骨髓瘤细胞上的BCMA和CD38,通过增强基于亲和力的结合而提升了对多发性骨髓瘤细胞的结合特异性,并且与teclistamab、alnuctamab和EM-801相比,ISB 2001在体外不同水平表达的BCMA和CD38中显示出更高的肿瘤细胞杀伤能力。
5.Septerna公司完成1.5亿美元B轮融资。诺奖得主Robert Lefkowitz联合创立的Septerna公司宣布完成1.5亿美元的B轮融资。Septerna专注于开发针对GPCR家族的新型口服小分子药。此轮融资将主要用于推进其靶向甲状旁腺激素受体1(PTH1R)以治疗甲状旁腺功能减退症的先导项目达到临床机制验证阶段,以及推进其靶向促甲状腺激素受体(TSHR)的临床前项目和其他早期项目的开发。
6.眼科细胞治疗公司完成A轮融资。再生细胞治疗公司Tenpoint宣布完成7000万美元金额的A轮融资,以推进其再生医学技术平台,开发基于工程化的体外细胞疗法和体内重编程的细胞疗法,用于恢复眼部退行性疾病患者的视力。该公司旨在通过用健康细胞替代病变细胞来解决视力丧失的根本原因,从而使视力得到永久的恢复。首席执行官兼再生眼科专家Eddy Anglade博士将加入Tenpoint董事会和科学创始人团队。
医药热点
1.第三批国家安宁疗护试点地区名单公布。为进一步推动安宁疗护发展,国家卫健委日前印发《关于开展第三批安宁疗护试点工作的通知》,确定北京市、浙江省、湖南省为第三批国家安宁疗护试点省(市),天津市南开区等61个市(区)为第三批国家安宁疗护试点市(区)。截至目前,三批国家级安宁疗护试点已覆盖全国185个市(区)。
2.重庆两江新区中医院新院区开工。7月15日,重医附属儿童医院“三大中心”、重庆两江新区中医院新院区在两江新区开工。此次开工建设的新院区总投资23.5亿,占地近85亩,建筑面积近20万平方米。新院区由综合楼、专科楼、感染楼、疾控中心在内的4栋楼构成,设置床位900张,配套车位1700余个,计划2026年建成投用。
3.河南首批临床服务五大中心名单公布。7月14日,河南省卫健委发布通知,公布首批临床服务五大中心名单。首批共28家医院建设达标:宜阳县人民医院等16家医院肿瘤中心建设达标;登封市人民医院等4家医院微创介入中心达标;巩义市人民医院麻醉疼痛中心达标;镇平县人民医院重症监护中心达标;巩义市人民医院等6家医院静脉血栓栓塞症中心建设达标。
评审动态
1. CDE新药受理情况(07月17日)
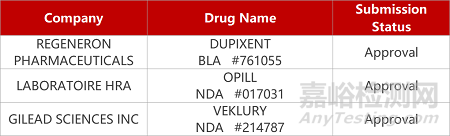
2. FDA新药获批情况(北美07月14日)