一般信息
“General Information”描述了确保药品质量所需的参考信息和参考测试方法,附在JP上。因此,一般信息被定位为JP的重要信息,尽管它不应被视为药品符合性的指示标准,但根据《药品和医疗器械等产品的质量,有效性和安全性确保法律》批准药品时指定的情况除外。
结合使用一般信息和JP有助于提高JP的质量和用户的便利性。一般信息根据其内容分为以下几类,每个一般信息都单独编号。
G1. 物理与化学
G2. 固态特性
G3. 生物技术/生物制品
G4. 微生物
G5. 生药(或中草药)
G6. 药物制剂
G7. 容器和包装
G8. 标准物质
GZ. 其他
凡例
1、日本药典的官方名称是:第十八改正日本薬局方,或简称为局十八,日局18, JP XVIII orJP 18。英文名为:The Japanese Pharmacopoeia, Eighteenth Edition.
2、在药品中 ,日本药典药品(JP药品)是各论中指定的药品。各论中采用的标题名称和常用名称应作为正式名称。在药品各论中,除英文名称外,还可酌情在标题中提及化学名称或拉丁名称。
3、生药及其相关产品放在官方各论后部的“Crude Drugs and Related Drugs”中。这些包括:以生药为活性成分的提取物、粉末、酊剂、糖浆、烈酒、液体提取物或栓剂,以及以生药为主要活性成分的组合制剂。
4、日本药品应按照相关各论、凡例(General notice)、生药通则(General Rules for Crude Drugs)、制剂通则(General Rules for Preparations)和一般检验(General Tests)中的规定进行检验,以确定其是否符合日本药典。但是,制剂各论中的“Description”以及“Containers and storage”和“Shelf life”仅供参考,不应被视为指示符合性标准。 然而,关于以生药为主要活性成分的制剂专著中“Containers and storage”下的容器则是符合性标准。
5、原则上,除非另有说明,否则用于制备JP药物或其来源材料的动物必须是健康的。
6、在英文版本中,各论中描述的JP药物以大写字母开头。
7、药物或化学品名称后面括号()中的分子式或结构式表示化学纯物质。分子量表示为小数点后两位。
8、以下是主要单位的缩写:
注意:核磁共振波谱学中使用的“ppm”表示化学位移,“w/v%”用于制剂的配方或组成。
9、用于表示JP药物效力的单位被认为是药物的数量。通常它由一定量的确定标准物质表示,该标准物质具有一定的生物活性,并且根据每种药物而有所不同。原则上,通过生物方法与每个参考标准进行比较来确定单位。JP药品中使用的术语“Unit”表示日本药典中定义的单位。
10、各论中的“Being Specified separately”一词是指根据药品和医疗器械等产品的质量、有效性和安全性保障法批准药品时应指定测试方法。
11、从质量保证的角度来看,除了质量标准之外,制造过程中应注意的要求(如果适用)会显示在各论的“Manufacture”标题中。它可能包含有关材料、制造过程和中间体控制的要求,以及生产过程中的测试和省略放行测试的要求。 即使在各论中没有 “Manufacture”的情况下,也要注意对单个药物的原材料,制造过程和中间体进行适当控制。
12、当从制造工艺验证研究、适当的制造工艺控制记录和质量控制的测试结果中获得一致的产品具有JP药品质量的保证时,各论中某些测试项目在产品放行时的要求可根据场合需要被省略。此外,基于过程数据(包括过程测试结果和过程参数监测数据)对最终产品(原料药和药品)进行质量评估,可以代替各论中的具体规定和测试方法,或者在适当的情况下作为测试方法。
13、日本药典中规定的测试方法可以用替代方法代替,这些方法应具有更好的准确性和精密度。但是,如果怀疑测试结果存在差异,则只有通过药典中给出的程序获得的结果才对最终判断有效。
14、原则上测试或储存的温度应以具体数字描述。但是,以下表达式可能会用到。
15、为了测量滴的数量,应使用在20°C下输送20滴重0.90 ~ 1.10克的水的滴注装置。
16、除非另有说明,“真空”一词表示压力不超过2.0kPa。
17、除非另有说明,否则溶液的酸度或碱度由蓝色或红色石蕊纸确定。若需更精确地指示这些特性,则使用pH值。
18、下表中的术语用于表示生药的切割程度或粉末药物的细度。
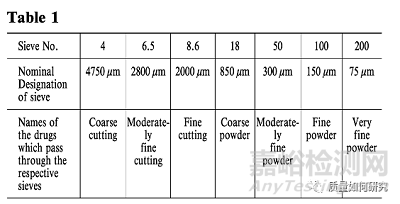
19、用于药物试验的水应为适合进行相关试验的水,如不含任何会干扰试验的物质。
20、若在描述溶液时未指明溶剂,通常指水溶液。
21、(1 in 3)、(1 in 10)或(1 in 100)的溶液表述是指1g溶质或1ml溶质用溶剂溶解或稀释到相应的体积3mL、10mL或100mL中。用(10:1)或(5:3:1)表述的混合液是指各液体按体积比进行混合。
22、“准确称量”是指考虑测试目的和相关称量装置将重量称到0.1mg,10 µg,1µg或0.1µg。“精确称量”是指称量到给定的小数位。
23、在JP药物测试中,应通过将“n+1”的数字四舍五入来获得“n”数字的值。
24、除非另有说明,否则JP药物的所有测试应在常温下进行,并在操作后立即观察结果。但是,对受温度影响的测试的判断应基于标准温度下的条件。
25、JP药物测试中使用的术语“immediately”/“at once”意味着该程序将在前一个程序后30秒内进行。
26、在“Description”部分,“白色”通常是指白色或几乎白色,“无色”是指无色或几乎无色。除非另有说明,颜色的观察是将1g固体药品铺在一张白纸上或放在白纸上的表面皿上。液体药品则是放在15mm内径的无色试管中,在白色背景下透过30mm的溶液观察。对于溶液澄清度的测试,操作方法相同,背景可以为黑色或白色。对于液体药品的荧光检查,则只能使用黑色背景。
27、在“Description”部分,“无味”是指无味或几乎无味。除非另有规定,气味的测试是将1g固体药品或1ml液体药品放在烧杯中。
28、在“Description”部分,溶解度的表达有以下类型。除非另有规定,溶解度是指JP药品的溶解程度。对于固体药品必要时预先粉碎,在20 ± 5˚C条件下,每隔5min强烈振摇30s,观察它在溶剂中的溶解情况。
29、在药物测试中,术语“溶解”或“混溶”表示它溶解或以任意比例与溶剂混合以形成澄清溶液或混合物。除药物以外的不溶性物质(包括纤维)不应被检测到或几乎看不见。
30、 鉴定是根据药物的特定特性识别药物活性成分的测试。
31、 纯度是检测药物中杂质/污染物的测试,它以及各论中的其他要求通常通过限制杂质/污染物的种类/性质和数量来指定药物的纯度。进行纯度测试的杂质/污染物是指在制造过程或储存过程中产生/污染的杂质/污染物,包括重金属、砷等有害物质。如果使用或添加任何异物,则必须进行测试以检测或限制此类物质的存在。
32、原则上,JP药品根据一般测试中的元素杂质要求进行适当控制。当药品中的元素杂质按照指示进行适当控制时,无需对各论中规定的重金属和砷等元素杂质进行测试,包括但不限于药品、原料药和辅料的元素杂质。
33、原则上,除非各论中另有说明,否则JP药物将根据一般测试中的残留溶剂下的要求进行适当控制。
34、考虑到故意掺入药品中的有害物质,必要时可在各论的“Potential adulteration”中描述是否存在污染物的控制要求。这些物质通过对材料、制造工艺、中间体或最终产品的测试来控制。根据质量风险管理部分的控制策略,每个药品单独指定这些检查的必要性和频率。
35、除另有规定外,在干失或炽灼中“恒重”是指经过额外1小时的干燥或炽灼后重量的差异不超过上一次干燥样品或炽灼残渣的0.10%。对于生药,重量的差异为不超过0.25%。与此同时,当用分析天平秤重时差异不超过0.5mg,半微量天平秤重不超过50µg,或微量天平秤重不超过5µg时,也可认为达到了恒重。
36、含量测定是通过物理,化学或生物程序确定药物的组成,活性成分的含量和效力单位的测试。
37、在表达含量测定的合适数量时,使用“about”一词表示在指定质量的10%以内的量。 “dry”一词表示样品应按照各论中的干燥失重方法在相同条件下完成干燥。
38、对于各论中含量测定中确定的成分的含量,如果简单地表示为“不低于一定百分比”而不标明其上限,则101.0%被理解为上限。
39、无菌是指通过指定方法未检测到目标微生物的条件。灭菌是指杀死或去除待灭菌物体中的所有活微生物的过程。无菌技术是维持无菌状态的受控技术。
40、容器是盛放JP药物的设备。塞子或盖子等被视为容器的一部分。容器没有影响内容物的指定描述和质量的物理和化学反应性。
41、密闭的容器(A well-closed container)可保护内容物免受外来固体的影响,并在常规或自定义的处理、运输和储存条件下防止药物丢失。如果指定了密闭容器,也可以用密封容器代替(tight container)。
42、密封的容器(tight container)可保护内容物免受外来固体或液体的影响,防止内容物丢失,以及在常规或自定义的处理、运输和储存条件下风化、潮解或蒸发。如果指定了密封容器,则可以用熔封容器(hermetic container)代替。
43、熔封容器(hermetic container)在常规或自定义的处理、运输和储存条件下不受空气或任何其他气体的影响。
44、“遮光”(light-resistant)是指它可以防止光的透射影响内容物的特定特性和质量,并在常规或自定义的处理、运输和储存条件下保护所含药物免受光照。
45、就JP药物而言,各论中活性成分单位的含量或效力必须在其直接容器或包装上显示。
46、JP药物的来源,数值或物理性质,及各论中的特殊标签要求规定,必须在其直接容器或包装上显示。
47、 日本药典、欧洲药典和美国药典之间的统一一般测试和各论中有这样的声明。文本的各个部分中不协调的用下面的符号图片表示。







