今日头条
璎黎PI3Kδ抑制剂拟纳入优先审评。璎黎药业自主研发的林普利塞片获CDE拟纳入优先审评,拟定适应症为既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者,既往接受过一线充分治疗的复发/难治性外周T/NK细胞淋巴瘤成人患者。林普利塞片是首个国产磷酯酰肌醇3-激酶亚型δ(PI3Kδ)抑制剂,此前已获国家药监局附条件批准上市,商品名:因他瑞,用于治疗复发或难治滤泡性淋巴瘤。
国内药讯
1.先声引进CDK4/6抑制剂新适应症报产。先声药业从G1 Therapeutics引进的CDK4/6抑制剂注射用盐酸曲拉西利的新适应症上市申请获CDE受理,用于广泛期小细胞肺癌(ES-SCLC)患者,在接受含拓扑替康方案治疗前给药,以降低化疗引起的骨髓抑制的发生率。Trilaciclib是一种骨髓保护剂,2021年2月已获FDA批准上市,商品名为Cosela。本次新适应症申请旨在将该产品在ES-SCLC患者上的应用拓展至二线及以上化疗中的应用。
2.东阳光英强布韦报丙肝NDA。东阳光丙肝1类化药英强布韦片的上市申请获CDE受理。今年5月,东阳光已完成一项评价磷酸安泰他韦胶囊联合英强布韦片治疗成人慢性丙型肝炎的Ⅱ/Ⅲ期临床研究,以治疗结束后12周时实现持续病毒学应答的受试者百分比(SVR12)为衡量指标,评估联合治疗成人各基因型慢性丙型肝炎的效果。目前,这款丙肝病毒(HCV)NS5A抑制剂磷酸安泰他韦胶囊的上市申请已获得CDE受理。
3.百奥泰FRα靶向ADC早期临床积极。百奥泰靶向叶酸受体α的ADC药物BAT8006在治疗晚期实体瘤的Ⅰ期临床剂量爬坡研究中获积极结果。纳入的受试者无FRα表达水平的要求,囊括了卵巢癌、乳腺癌、非小细胞肺癌和宫颈癌等多个瘤种,其中卵巢癌受试者占比约60%。数据显示,BAT8006的总体ORR为31%,DCR为86.2%;BAT8006在TPS>25%的卵巢癌患者中,ORR达到58.3%。
4.信达B7-H3靶向ADC启动Ⅰ/Ⅱ期临床。信达生物靶向B7-H3的ADC新药IBI129在Clinicaltrials.gov网站上登记注册一项Ⅰ/Ⅱ期临床,拟评估用于治疗复发性或转移性实体瘤安全性、耐受性和初步抗肿瘤活性。预计2024年底初步完成。IBI129是信达生物第4款进入临床阶段的ADC新药。此前,信达生物的IBI343(Claudin18.2 ADC)、IBI354(HER2 ADC)、IBI130(Trop2 ADC)已陆续进入临床开发。
5.烨辉Menin抑制剂国内获批临床。烨辉医药1类化药BN104片获国家药监局临床试验默示许可,拟开发用于治疗复发/难治性急性白血病。BN104是一款新型、高选择性的口服Menin抑制剂,已在针对急性白血病的临床前研究中显示出明显更大的安全窗口和同类最佳的治疗潜力。今年4月,该新药已获得FDA授予的治疗急性髓系白血病(AML)的孤儿药资格。
6.恒瑞TSLP单抗超10亿美元海外授权。恒瑞医药宣布与美国One Bio公司就其胸腺基质淋巴细胞生成素(TSLP)单抗药物SHR-1905达成合作协议,授予后者在大中华区外的开发、生产和商业化SHR-1905的全球独家权益。SHR-1905可阻断炎症细胞因子的释放,抑制下游炎症信号的传导,有潜力治疗哮喘、慢性鼻窦炎伴鼻息肉(CRSwNP)患者。根据协议,恒瑞将获得2500万美元首付款和近期里程碑,累计不超过10.25亿美元的研发及销售里程碑后期付款,以及产品的销售分成。
国际药讯
1.FDA发布细胞和基因疗法制造指南。近日,FDA发布一份针对细胞和基因疗法开发的指南草案,对研发过程中制造工艺的改变等方面给出指导意见。FDA建议在启动临床试验之前引入任何大规模的制造改变;进行临床试验时,应使用与商业化制造相同的制造流程,这有助于简化扩展制造规模的过程;即使制造过程没有改变,开发商应该进行年度数据评估,以确定产品指标或生产和质量控制程序是否需要任何改变。指南草案还建议根据长期储存条件下的实时稳定性数据来确定制品有效期。
2.辉瑞CD3/BCMA双抗获FDA批准上市。辉瑞CD3/BCMA双抗ELREXFIO(elranatamab)获FDA加速批准上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM)。一项Ⅱ期MagnetisMM-3临床数据显示,在中位随访为10.4个月时,elranatamab在既往至少接受过四种治疗的患者中达到61%的客观缓解率以及55%的非常好的部分缓解率。这是继强生Tecvayli(teclistamab-cqyv)后第二款在美国获批的CD3/BCMA双抗。
3.新一代A型肉毒素获FDA批准新适应症。Revance公司A型肉毒杆菌毒素Daxxify获FDA批准扩展适应症,用于治疗颈部肌张力障碍。Daxxify属于新型长效神经调节剂,通过阻断神经冲动,暂时抑制肌肉运动。2022年9月,该产品已获得FDA首次批准,用于暂时改善成人的眉间皱纹。复星医药子公司复星医药产业拥有该新药的中国独家权益。
4.罕见病ASO疗法早期临床积极。韩国科学技术院研究团队针对共济失调毛细血管扩张(A-T)罕见病患儿进行全基因组测序而开发的新型反义寡核苷酸(ASO)疗法,在治疗A-T罕见病患儿的临床研究中获积极结果。3年治疗数据显示,该疗法耐受性良好,该研究为前瞻性地识别可能会因剪接开关ASO疗法获益的个体提供一种框架。研究成果近期已发表在Nature期刊上。
5.精神病学药物公司BioXcel裁员超百人。8月14日,BioXcel公司宣布调整战略,计划将员工人数从190人减少到80人。受此消息影响,该公司股价下跌44%,总市值仅剩1亿美元左右。今年6月,该公司右美托咪定舌下膜剂BXCL501在治疗阿尔茨海默症相关激越的III期TRANQUILITY II研究积极数据遭到质疑,当即股价大跌64%。BioXcel表示已聘请独立第三方对临床数据完整性进行审计,并要求与FDA会晤,讨论支持BXCL501上市申请所需的临床数据。
医药热点
1. 全国首家慢性进展期肝病数字化管理中心成立。近日,慢性进展期肝病数字化管理(CDM)中心落地东南大学附属中大医院。这是全国首家CDM中心,将立足于东南大学附属中大医院感染性疾病科,通过联合消化内科、介入与血管外科、超声医学科、医学检验科、放射科等多学科力量,旨在共同做好慢性进展期肝病患者的全程管理和规范化诊疗,减少其就医难度和复杂度,提高患者生活质量,有效助力我国慢病防治事业的高质量发展。
2.海南省预防医学科学院正式挂牌。8月14日上午,海南省疾控中心在新址隆重举行新址揭牌暨海南省预防医学科学院挂牌仪式。新址占地120亩,建筑面积6万多平方米,具有先进的仪器设备和海南省首家生物安全防护三级实验室。海南省预防医学科学院正式挂牌,将进一步推动研究体系和科研平台建立、推动科技成果转化和落地,构筑“联防联控”新机制,提升海南公共卫生安全风险防范能力。
3.江西省眼科医院正式挂牌。8月12日,江西省眼科医院挂牌仪式在南昌大学附属眼科医院举行。南大附属眼科医院增挂江西省眼科医院的牌子,将构建了南昌大学附属眼科医院、江西省眼科医院和南昌大学眼视光学院“三位一体”的管理体制,既是满足广大人民群众日益增长的眼健康需求的新举措,也是江西向着建立区域眼科医疗中心迈出的新步伐。
评审动态
1. CDE新药受理情况(08月15日)
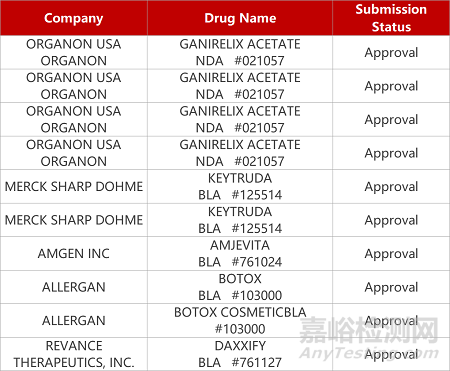
2. FDA新药获批情况(北美08月14日)