您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-08-21 09:30


|
序号 |
法规 |
|
1 |
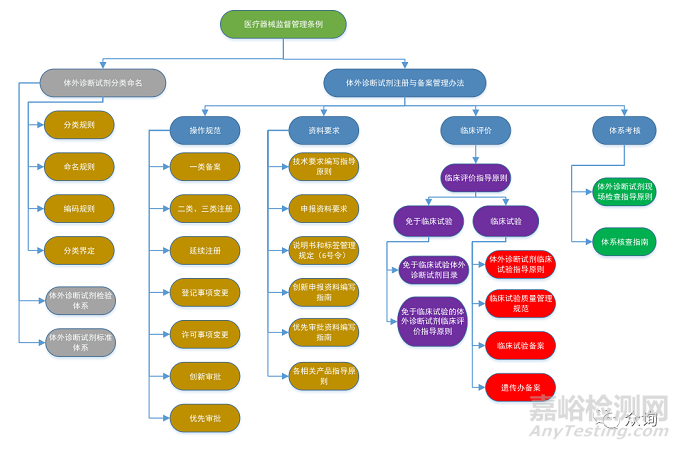
《医疗器械监督管理条例》国务院令第739号 |
|
序号 |
法规 |
|
1 |
《医疗器械注册与备案管理办法》国家市场监督管理总局令第47号 |
|
2 |
《体外诊断试剂注册与备案管理办法》国家市场监督管理总局令第48号 |
|
3 |
《医疗器械说明书和标签管理规定》国家药品监督管理局令第6号 |
|
4 |
《医疗器械生产监督管理办法》国家药品监督管理局令第7号 |
|
5 |
《医疗器械经营监督管理办法》国家药品监督管理局令第8号 |
|
6 |
《药品医疗器械飞行检查办法》国家食品药品监督管理总局令第14号 |
|
7 |
《医疗器械使用质量监督管理办法》国家食品药品监督管理总局令第18号 |
|
8 |
《医疗器械通用名称命名规则》国家食品药品监督管理总局令第19号 |
|
9 |
《医疗器械临床试验质量管理规范》国家药品监督管理局令第25号 |
|
10 |
《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号) |
|
11 |
《国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定》国家食品药品监督管理总局令第32号 |
|
12 |
《医疗器械标准管理办法》国家食品药品监督管理总局令第33号 |
|
13 |
《医疗器械网络销售监督管理办法》(国家食品药品监督管理总局令第38号) |
|
14 |
《医疗器械不良事件监测和再评价管理办法》国家市场监督管理总局令第1号 |
|
15 |
《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法》国家市场监督管理总局令第21号 |
|
序号 |
法规 |
|
1 |
《关于发布医疗器械产品技术要求编写指导原则的通告(2014年第9号)》 |
|
2 |
《关于发布体外诊断试剂说明书编写指导原则的通告(2014年第17号)》 |
|
3 |
《关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(2015年第101号)》 |
|
4 |
《关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(2015年第102号)》 |
|
5 |
《关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(2015年第103号)》 |
|
6 |
《关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械[2015]218号)》 |
|
7 |
《关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管[2016]35号)》 |
|
8 |
《关于发布医疗器械临床试验机构条件和备案管理办法的公告(2017年第145号)》 |
|
9 |
《关于发布医疗器械临床试验设计指导原则的通告(2018年第6号)》 |
|
10 |
《关于发布医疗器械通用名称命名指导原则的通告(2019年第99号)》 |
|
11 |
国家药监局关于发布医疗器械注册质量管理体系核查指南的通告(2020年 第19号) |
|
12 |
《关于发布需进行临床试验审批的第三类医疗器械目录(2020年修订版)的通告(2020年第61号)》 |
|
13 |
《国家药监局关于发布免于临床评价医疗器械目录的通告(2021年第71号)》 |
|
14 |
《国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(2021年第73号)》 |
|
15 |
《国家药监局关于发布免于临床试验的体外诊断试剂临床评价技术指导原则的通告(2021年第74号)》 |
|
16 |
《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》国家药品监督管理局通告2021年第121号 |
|
17 |
《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》国家药品监督管理局通告2021年 第122号 |
|
18 |
国家药监局关于发布《医疗器械注册自检管理规定》的公告(2021年第126号) |
|
19 |
国家药监局关于发布《体外诊断试剂分类规则》的公告(2021年第129号) |

|
申报资料一级标题 |
申报资料二级标题 |
|
|
体外诊断试剂 |
医疗器械 |
|
|
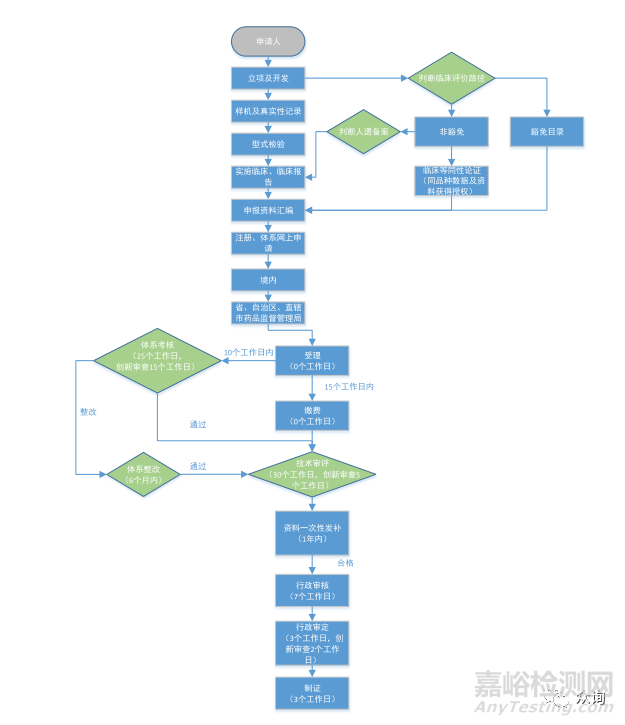
1.监管信息 |
1.1章节目录 1.2申请表 1.3术语、缩写词列表 1.4产品列表 1.5关联文件 1.6申报前与监管机构的联系情况和沟通记录 1.7符合性声明 |
|
|
2.综述资料 |
2.1章节目录 2.2概述 2.3产品描述 2.4预期用途 2.5申报产品上市历史 2.6其他需说明的内容 |
|
|
3.非临床资料 |
3.1章节目录 3.2产品风险管理资料 3.3体外诊断试剂安全和性能基本原则清单 3.4产品技术要求及检验报告 3.5分析性能研究 3.6稳定性研究 3.7阳性判断值或参考区间研究 3.8其他资料 |
3.1章节目录 3.2产品风险管理资料 3.3医疗器械安全和性能基本原则清单 3.4产品技术要求及检验报告 3.5研究资料 3.6非临床文献 3.7稳定性研究 3.8其他资料 |
|
4.临床评价资料 |
4.1章节目录 4.2临床评价资料 4.3其他资料 |
|
|
5.产品说明书和标签样稿 |
5.1章节目录 5.2产品说明书 5.3标签样稿 5.4其他资料 |
|
|
6.质量管理体系文件 |
6.1综述 6.2章节目录 6.3生产制造信息 6.4质量管理体系程序 6.5管理职责程序 6.6资源管理程序 6.7产品实现程序 6.8质量管理体系的测量、分析和改进程序 6.9其他质量体系程序信息 6.10 质量管理体系核查文件 |
|
|
国家药品监督管理局注册收费标准汇总 |
|||||
|
序号 |
类别/区域 |
首次注册费 |
变更注册费 |
延续注册费 |
实施时间 |
|
1 |
进口Ⅱ类 |
21.09 |
4.2 |
4.08 |
2015.05.27 |
|
2 |
进口Ⅲ类 |
30.88 |
5.04 |
4.08 |
2015.05.27 |
|
3 |
国产Ⅲ类 |
15.36 |
5.04 |
4.08 |
2015.05.27 |
|
4 |
临床试验申请费(高风险医疗器械4.32万元) |
||||
|
各省、自治区第Ⅱ类医疗器械注册收费标准汇总 |
|||||
|
5 |
福建 |
5.77 |
2.42 |
2.39 |
2018.09.20 |
|
6 |
江西 |
5.467 |
2.289 |
2.268 |
2020.02.21 |
|
7 |
上海 |
6.573 |
2.751 |
2.73 |
2018.10.01 |
|
8 |
海南 |
8.3 |
3.44 |
3.41 |
2016.03.01 |
|
9 |
山东 |
8.22 |
3.44 |
3.41 |
2016.04.01 |
|
10 |
内蒙古 |
0 |
0 |
0 |
2016.05.11 |
|
11 |
北京 |
0 |
0 |
0 |
2016.07.01 |
|
12 |
安徽 |
5.005 |
2.093 |
2.079 |
2019.11.1 |
|
13 |
浙江 |
6.573 |
2.2008 |
2.184 |
2020.7.1-2020.12.31 |
|
14 |
陕西 |
0 |
0 |
0 |
2016.10.01 |
|
15 |
吉林 |
0 |
0 |
0 |
2020.02.10 |
|
16 |
河北 |
7.23 |
3.03 |
3 |
2016.11.11 |
|
17 |
江苏 |
5.915 |
2.471 |
2.457 |
2018.12.19 小微企业免首次注册费 |
|
18 |
宁夏回族自治区 |
1.5 |
0.65 |
0.65 |
2020.01.01 |
|
19 |
天津 |
0 |
0 |
0 |
2019.01.01 |
|
20 |
黑龙江 |
5.76 |
2.416 |
2.4 |
2017.08.01 |
|
21 |
广东 |
5.726 |
2.394 |
2.38 |
2019.01.13 |
|
22 |
湖南 |
5.04 |
2.114 |
2.1 |
2019.04.11 |

|
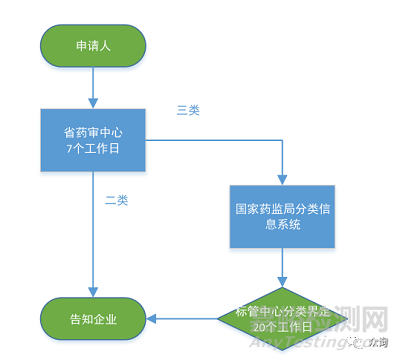
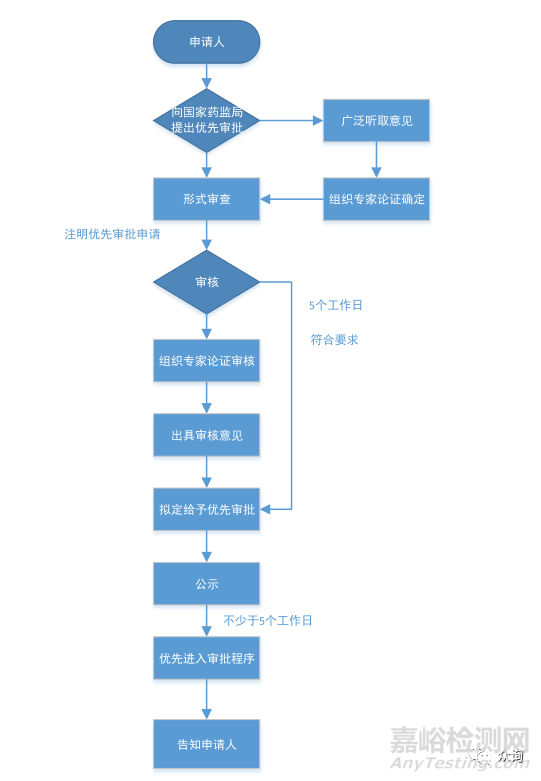
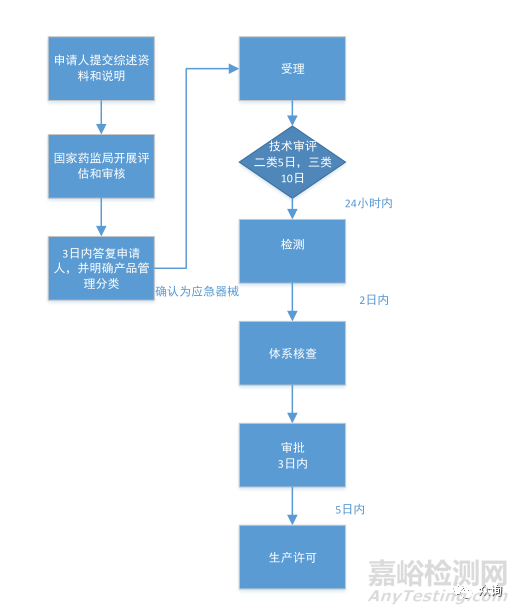
创新特别审批程序 |
优先审批程序 |
|
|
一、申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,载明产品核心技术方案具备新颖性和创造性。 |
一、符合下列情形之一的医疗器械: 1. 诊断或者治疗罕见病,且具有明细那临床优势; 2. 诊断或者治疗恶性肿瘤,且具有明显临床优势; 3. 诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段; 4. 专用于儿童,且具有明显临床优势; 5. 临床急需,且在我国尚无同品种产品获准注册的医疗器械。 |
|
|
二、产品主要工作原理/ 作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。 |
二、列入国家科技重大专项或者国家重点研发计划的医疗器械。 |
|
|
三、申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。 |
三、其他应当优先审批的医疗器械。 |
|
|
创新特别审批与优先审批相同点 |
||
|
1.都必须在医疗器械监督管理条例和医疗器械注册管理办法的大前提下实施 |
||
|
2.标准不降低,程序不减少 |
||
|
3.都能享受一些优惠政策 |
||
|
4.注册申报资料的审评都根据分类管理的原则移交相应的审评部门 |
||
|
创新特别审批与优先审批差异 |
||
|
创新特别审批 |
优先审批 |
|
|
委托生产 |
样品可以委托生产 |
样品可以委托生产 |
|
申报资料 |
审批通过后方能提交注册申报 |
可与注册申报资料同时提交 |
|
相关规范 |
相对成熟,有实际操作指导 |
规范较少,对实际操作指导较少 |
|
审批部门 |
先经省局初审,通过后上报国家局(境外例外) |
直接向国家局提交申请 |
|
后果 |
申请被驳回后可再申请 |
申请不被批准直接转入普通程序 |

来源:Internet


