近期,西南交通大学翁杰、谭欢和南京儿童医院郑朋飞研究员在科爱创办的期刊Bioactive Materials上联合发表研究性文章:3D打印具有抗菌潜力的三元素掺杂羟基磷灰石/聚己内酯复合支架用于骨肉瘤治疗和骨再生。体外研究表明Se、Sr和Zn掺杂羟基磷灰石(Se/Sr/Zn-HA)具有良好的生物相容性、抗菌性、抗肿瘤和促成骨功能,其与聚己内酯混合制备的复合支架(Se/Sr/Zn-HA-PCLs)表现出良好的保真度和力学性能。体内研究证实Se/Sr/Zn-HA具有优异的抗肿瘤效果,Se/Sr/Zn-HA-PCLs能有效促进骨缺损修复。
1、研究内容简介
骨肉瘤是一种常见的恶性骨肿瘤,主要发生于儿童和青少年,已成为引起青少年癌症死亡的第二大原因。目前,骨肉瘤的主要治疗方法包括手术切除、化疗和放疗,而骨肉瘤引起的骨缺损常通过自体骨移植修复,但手术切除不能完全消除病灶部位残留的骨肿瘤细胞,残留肿瘤细胞可增殖转移,增加肿瘤复发风险。此外,骨肉瘤对放疗无反应,且有很高的化疗耐药倾向。自体骨移植治疗骨肉瘤切除术引起的骨缺损是一种替代方法,但存在供体部位并发症、免疫排斥反应和供应有限等多个问题,限制了其临床应用。因此,开发具有修复骨肉瘤引起的骨缺损,又能消除癌细胞并抑制细菌感染的人工骨替代物成为临床亟待解决的问题。羟基磷灰石(HA)是人体硬组织的主要无机成分,因其优异的生物相容性、骨传导性和生物活性而广泛用于骨组织工程。不同的微量元素在骨组织的生长发育中发挥不同的作用。例如,锌(Zn)、锰(Mn)和锶(Sr)具有良好的成骨作用;镁(Mg),铜(Cu)以及钴(Co)具有出色的血管生成作用;硅(Si)和硼(B)具有成骨和血管生成作用;硒(Se)可以促进骨组织发育、抗肿瘤和抗衰老。然而,单元素掺杂HA很难修复由骨肉瘤引起的骨缺损,而多元素掺杂HA具备的复合功能使其在修复骨肉瘤引起的骨缺损中具有潜力。据悉,使用三元素掺杂HA治疗骨肉瘤,修复骨缺损和术后抗感染的研究较少。因此,本研究旨在设计并制造一种多功能支架,在消除肿瘤的同时修复骨缺损,并预防骨肉瘤的术后感染。如图1所示,将水热法合成的Se、Sr和Zn共掺杂HA(Se/Sr/Zn-HA)和聚己内酯(PCL)混合并通过3D打印技术制备Se/Sr/Zn-HA-PCLs复合支架,并验证Se/Sr/Zn-HA的抗菌潜力和评估Se/Sr/Zn-HA的体外和体内抗肿瘤特性,以及促成骨分化潜力。最后在大鼠股骨缺损模型验证了Se/Sr/Zn-HA-PCLs的骨缺损修复功能。
图 1. 用于肿瘤治疗、骨缺损修复和抗菌的Se/Sr/Zn-HA和Se/Sr/Zn-HA-PCLs的制备和功能示意图。
一、HA和元素掺杂HA的制备和表征
本研究采用水热法合成HA和元素掺杂HA,其优点是反应温度低,产物结晶度好,产品形貌易于控制,为获得亚微米甚至纳米级或纳米结构材料提供了可能性。SEM结果表明,纯HA呈带状晶体形状(图2 A),长度为2–10 μm,宽度为1 μm,Se-HA促进片状的聚集,而长度缩短至2–5 μm,宽度有所增加。与Se-HA相比,Sr-HA表现出更规则的放射花瓣状结构,其平均宽度约为5 μm,并且有少数不完整微球结构,表明Sr-HA随着掺杂量增加从放射花瓣状结构转变为球状结构。Zn-HA的颗粒形态相对均匀,由薄片聚集形成直径约7-9μm的规整微球结构。Se/Sr-HA是一种球状连接结构,由薄片聚集组成,球状结构为径向,与Sr-HA的结构相似。Se/Zn-HA是薄片聚集而成的球形结构,且薄片相对稀疏,球形度不如Zn-HA,直径为15–25 μm。Sr/Zn-HA呈规则球形结构,为稀疏和径向片状,部分Sr/Zn-HA的薄片密度大于Zn-HA,直径为20–30 μm。Se/Sr/Zn-HA由放射状花瓣状和微球组成,微球直径范围为2-10 μm,径向花瓣状结构与Sr-HA结构相似,微球状结构与Zn-HA结构一致。三元素掺杂的Se/Sr/Zn-HA的形貌与Se-HA、Sr-HA或Zn-HA的组合形貌相似。采用XRD分析样品物相,结果表明,元素掺杂 HA的衍射峰与HA标准图(JCPDS09-0432)相似,元素掺杂的HA样品保持HA的主相(图2B)。采用FTIR分析掺杂HA的化学结构(图2C),在所有样品的FTIR光谱中均显示了HA的官能团吸收峰。EDS(图2D)结果表明,Zn、Sr和Se在Se/Sr/Zn-HA表面均匀分布,表明Se/Sr/Zn-HA的成功制备。
图 2. HA、Se-HA、Sr-HA、Zn-HA、Se/Sr-HA、Se/Zn-HA、Sr/Zn-HA 和 Se/Sr/Zn-HA 的表征。(A)SEM图像,(B)XRD图谱,(C)FTIR光谱和(D)Se/Sr/Zn-HA的元素分布。
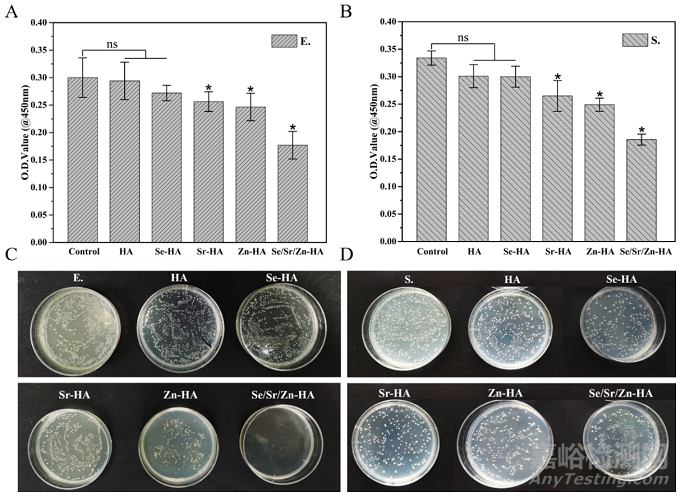
二、HA和元素掺杂HA的抗菌性评价
将HA、Se-HA、Sr-HA、Zn-HA和Se/Sr/Zn-HA浸提液和金黄色葡萄球菌和大肠杆菌共培养后进行定量分析,细菌的活性如图3A和图3B所示。HA和Se-HA抗菌效果略优于对照组,Sr-HA和Zn-HA组比Se-HA和对照组的抗菌效果更好,尤其是Zn-HA,这与Zn2+优异的抗菌功能有关。虽然Sr-HA、Zn-HA和Se/Sr/Zn-HA的抗菌效果与对照组有显著差异,但Se/Sr/Zn-HA浸提液与大肠杆菌或金黄色葡萄球菌共培养后均表现出最佳的抗菌效果,表明SeO32−、Sr2+和Zn2+的协同给药获得最佳的抗菌效果。将样品浸提液和细菌悬液涂覆到固体培养基上,观察菌落生长。虽然Se/Sr/Zn-HA的金黄色葡萄球菌菌落密度高于大肠杆菌,但Se/Sr/Zn-HA仍表现出优越的抗菌效果,表明SeO32−、Sr2+和Zn2+联合给药可获得最佳的抗菌效果。综上所述,Se/Sr/Zn-HA对金黄色葡萄球菌和大肠杆菌均具有最佳的抗菌效果,证实了SeO32−、Sr2+和Zn2+协同给药的抗菌优势。
图 3. HA,Se-HA,Sr-HA,Zn-HA和Se/Sr/Zn-HA浸提液与细菌共培养24小时的抗菌性能评价。(A)浸提液与大肠杆菌共培养后的OD值;(B)浸提液与金黄色葡萄球菌共培养后的OD值;(C)大肠杆菌和浸提液共涂板;(D)金黄色葡萄球菌和浸提液共涂板。
三、HA和元素掺杂HA的体外成骨分化评价
通过检测样品浸提液和大鼠骨髓间充质干细胞(BMSCs)共培养后的ALP活性和茜素红染色来评估样品促成骨分化能力。培养7天后,元素掺杂HA组的ALP活性与对照组相比无明显差异(图4A),但BMSC表现出分化成骨细胞的趋势。培养14 天后,HA的ALP活性强于对照组,并观察到成骨分化,而Se/Sr/Zn-HA培养的BMSCs ALP水平显著高于对照组。Zn-HA对ALP活性的影响最小,培养7天和14天后ALP水平均略高于对照组。Se/Sr/Zn-HA含有上述离子,具有良好的促骨分化潜力。
茜素红染色结果与ALP结果相似,但Zn-HA比对照组、HA和Se-HA可促进更多的钙质沉积,如图4B所示。与对照组相比,材料组均有明显的钙质沉积。此外,随着元素类型的增加,钙质沉积的效果变得更明显。由此可见,SeO32−、Sr2+和Zn2+均可促进BMSCs的成骨分化,三者的协同给药可达到最佳的成骨分化效果。免疫荧光染色显示BMSCs呈多角星形扩散而无分化(图4C),表明BMSCs培养7天后形态没有发生变化;而与Se/Sr/Zn-HA共培养的BMSCs形态却发生显著变化,细胞长宽比增加,细胞假足延伸形成拉伸结构,表明SeO32−、Sr2+和Zn2+协同给药能促进BMSCs的铺展。
图 4. HA,Se-HA,Sr-HA,Zn-HA和Se/Sr/Zn-HA的体外成骨分化潜力评价。(A)BMSC在用HA,Se-HA,Sr-HA,Zn-HA和Se/Sr/Zn-HA培养7天和14天后ALP的分泌水平;(B)用HA,Se-HA,Sr-HA,Zn-HA,Se/Sr-HA,Se/Zn-HA,Sr/Zn-HA和Se/Sr/Zn-HA的α-MEM培养BMSCs 21天后的ARS染色;(C)用Se/Sr/Zn-HA的α-MEM培养BMSC7天后的罗丹明标记鬼笔环肽和DAPI免疫荧光染色。
四、HA和元素掺杂HA的体外抗肿瘤评价
将HA和元素掺杂HA浸提液与人骨肉瘤细胞(143b)共培养来评价材料的体外抗肿瘤能力。结果显示,含有SeO32−浸提液的143b数量最少,且与其他组存在显著差异,表明SeO32−具有更好的抗肿瘤作用,如图5A所示。培养1 天后,Zn-HA的143b数量高于Sr-HA和对照组;培养3 天后,材料组143b数量均低于对照组;培养5天后,Zn-HA的143b数量低于Sr-HA,表明Zn2+发挥抗肿瘤作用的时间较长。培养5 天后,除Sr/Zn-HA外,双元素掺杂HA的143b数量均低于单元素掺杂HA组和对照组,这与Sr2+抗肿瘤效果较差有关。虽然Sr2+抗肿瘤效果较差,但仍高于HA组和对照组。然而,在培养期间,Se/Sr/Zn-HA的143b数量均明显低于对照组和不含SeO32-组,表明Se/Sr/Zn-HA具有显著且持久的抗肿瘤作用。Tunel 染色结果表明,143b与 Se-HA 和 Se/Sr/Zn-HA 共培养3天后的存活率最低,如图 5B 所示。此外,含SeO32−浸提液均具有优异的抗肿瘤效果,而对照组、HA和Sr-HA几乎没有观察到143b凋亡,Se/Sr/Zn-HA中143b凋亡最多,这表明了Sr2+和Zn2+掺入进一步强化了SeO32−的抗肿瘤效果, SeO32−、Sr2+和Zn2+三者的协同给药能达到最佳的抗肿瘤能力。
图 5. HA,Se-HA,Sr-HA,Zn-HA,Se/Sr-HA,Se/Zn-HA,Sr/Zn-HA和Se/Sr/Zn-HA浸提液与143b共培养评价体外抗肿瘤潜力。(A)1 天、3 天和5天的OD值;(B)第3天的Tunell染色。
五、HA和元素掺杂HA的体内抗肿瘤评价
将各类HA分别与PBS混合后注射到荷瘤小鼠的肿瘤部位,结果如图6(A)和(B)所示。结果表明,注射PBS的小鼠肿瘤显着增大,而HA处理的小鼠肿瘤没有显著抑制,但仍略小于PBS处理的小鼠肿瘤。Sr-HA、Zn-HA和Sr/Zn-HA的抗肿瘤效果与HA相似,表明Sr2+和Zn2+的抗肿瘤效果较差。Se-HA、Se/Sr-HA、Se/Zn-HA和Se/Sr/Zn-HA的肿瘤显著小于其他组,表明SeO32−具有比Sr2+ 和Zn2+更好的抗肿瘤效果。Se/Sr-HA和Se/Zn-HA的抗肿瘤效果与Se-HA相当,表明Sr2+和Zn2+的掺入并没有削弱SeO32−的抗肿瘤效果,这与体外抗肿瘤结果一致。然而,Se/Sr/Zn-HA处理的小鼠的肿瘤最小。采用H&E(图6C)和Ki67染色(图6D)分析肿瘤组织内肿瘤细胞凋亡,结果显示对照组肿瘤细胞未发生明显凋亡,HA、Sr-HA、Zn-HA和Sr/Zn-HA的结果相似,表现出微小的抗肿瘤作用。而Se-HA、Se/Sr-HA、Se/Zn-HA和Se/Sr/Zn-HA给药后出现明显的肿瘤细胞凋亡,其抗肿瘤效果优于对照组、HA、Sr-HA、Zn-HA和Sr/Zn-HA,这与体外结果一致。因此,SeO32−具有优异的抗肿瘤效果,而SeO32−、Sr2+和Zn2+的协同给药增强了抗肿瘤效果。
图6. HA,Se-HA,Sr-HA,Zn-HA,Se/Sr-HA,Se/Zn-HA,Sr/Zn-HA和Se/Sr/Zn-HA体内抗肿瘤潜力评价。(A)处死小鼠后提取肿瘤;(B)样品注射后相对肿瘤体积随时间变化;(C)第8天肿瘤组织的H&E染色,比例尺:100μm;(D)第8天肿瘤组织的Ki67染色,比例尺:100μm。
六、HA-PCLs、Se-HA-PCLs、Sr-HA-PCLs、Zn-HA-PCLs 和 Se/Sr/Zn-HA-PCLs 支架的构建及体内成骨评价
本研究进一步采用PCL和HA的混合生物墨水结合3D打印技术构建多孔支架,相应支架的形貌如图7A所示。所有复合支架均表现出均匀且相互穿透的三维多孔结构,大孔尺寸约为350 μm。Sr-HA-PCLs和Se/Sr/Zn-HA-PCLs的表面较粗糙,其他组表面光滑,这与Sr-HA和Se/Sr/Zn-HA的结构有关。Se/Sr/Zn-HA-PCLs的横截面元素分布如图7B所示,横截面显示出直径约为400 μm的规则圆形轮廓,Se、Sr和Zn在支架内均匀分布,表明Se/Sr/Zn-HA和PCL均匀混合。
通过修复SD大鼠股骨缺损来评估支架的促成骨能力,结果如图7C所示。H&E染色表明,3D打印支架的成骨作用优于对照组。Se-HA-PCL、Sr-HA-PCLs和Zn-HA-PCLs的成骨作用优于HA-PCLs。Sr-HA-PCLs和Zn-HA-PCLs的成骨作用相似,Sr-HA-PCLs与对照组相似。Masson染色与H&E染色结果相似:HA-PCLs优于对照组,而Se-HA-PCLs,Sr-HA-PCLs和Zn-HA-PCLs优于HA-PCLs,Se/Sr/Zn-HA-PCLs的修复效果最佳。上述结果表明,SeO32−、Sr2+或Zn2+可以改善HA的成骨效果,且Se/Sr/Zn-HA-PCLs的效果优于Se-HA-PCLs,Sr-HA-PCLs和Zn-HA-PCLs,这与 ALP活性和茜素红染色结果相似。在这项研究中,SeO32−、Sr2+和Zn2+协同改善了HA的生物活性,表现出比HA或单元素掺杂HA更好的促骨、抗肿瘤和抗菌效果,从而显着提高骨修复效果,降低肿瘤复发的风险。
图 7. HA-PCLs、Se-HA-PCLs、Sr-HA-PCLs、Zn-HA-PCLs 和 Se/Sr/Zn-HA-PCLs 的表征。(A)SEM图像;(B) Se/Sr/Zn-HA-PCLs横截面元素分布。(C) 复合支架植入大鼠股骨4周和12周后的H&E和Masson染色;S代表支架,NB代表新骨;比例尺:1000 μm,放大区域比例尺:100 μm。
2、原文信息
Hao Huang, Lei Qiang,Minjie Fan, Yihao Liu, Anchun Yang, Dongbiao Chang, Jinsheng Li, Tong Sun,Yiwei Wang, Ruoyi Guo, Hanjie Zhuang, Xiangyu Li, Tailin Guo, Jinwu Wang, HuanTan***, Pengfei Zheng**, Jie Weng*.
3D-printed tri-element-doped hydroxyapatite/polycaprolactone composite scaffolds with antibacterial potential forosteosarcoma therapy and bone regeneration.
BioactiveMaterials, 31 (2024) 18-37.
DOI: 10.1016/j.bioactmat.2023.07.004.