2023年6月20日,欧盟更新了无预期医疗用途产品条例修正案,针对某些无预期医疗用途产品的过渡期条例进行了调整。
2023年9月26日,欧盟发布了一份Q&A文件“Q&A on transitional provisions for products without an intended medical purpose covered by annex XVI of the MDR”,旨在帮助无预期医疗用途产品制造商更好地理解过渡期的相关规定,具体内容如下:
1.CS何时适用于附录XVI的产品?
CS自2023年6月22日后,适用于MDR法规附录XVI中所列的无预期医疗用途的产品。
以及适用于2022年12月22日后,已由公告机构根据MDD法规颁布证书所涵盖的某些规定产品(见问题7)。
2.MDR何时适用于附录XVI产品?
MDR适用于2023年6月22日起的附录XVI产品,即CS的申请日期。
3.附录XVI产品的过渡期规定是什么?
MDR规定了6个月的过渡期,以允许实施CS中规定的新的适用要求。过渡期从2022年12月22日开始,到2023年6月22日结束。
此外,CS制定了专门的过渡条款,以涵盖MDR授予的6个月不足以完全实施CS的新适用要求和完成MDR下的适用程序的具体情况。具体情况包括:
①公告机构需要参与符合性评估程序
②制造商考虑在涉及公告机构的符合性评估程序之后进行临床调查
③附录XVI产品包含在根据MDR Article 120(2)不再有效的MDD证书中。
对于根据MDR Article 120(2)获得有效MDD证书的附录XVI产品,MDR Article 120(3)(3a)(3b)(3c)(3d)(3e)款中规定的过渡条款适用。
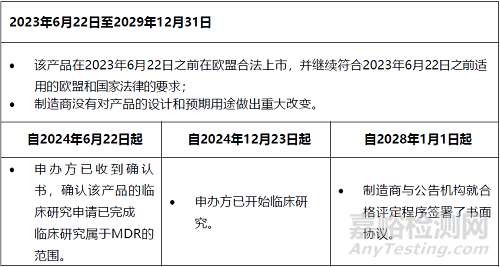
4.对于公告机构参与符合性评估且制造商决定进行临床调查的产品,CS规定的过渡期是什么?是否有需要满足的条件?
过渡期约为6.5年,从2023年6月22日开始,到2029年12月31日结束。
在过渡时期,需要满足各种条件。有些是在整个期间,而另一些则是在特定日期内。下表显示了在过渡期内产品继续投放市场或投入使用所需满足的每个条件。
表1:CS第2(1)条规定的过渡条款的适用条件
MDD证书涵盖的产品可以从问题6或7中描述的过渡期中受益。
5.对于公告机构参与符合性评估且制造商不进行临床调查的产品,CS规定的过渡期是什么?是否有需要满足的条件?
过渡期约为5.5年,从2023年6月22日开始,到2028年12月31日结束。
在过渡时期,需要满足各种条件。有些是在整个期间,而另一些则是在特定日期内。下表显示了在过渡期内继续将产品投放市场或投入使用所需满足的每个条件。
表2:根据CS第2(2)条的过渡条款的适用条件
MDD证书涵盖的产品可以从问题6或7中描述的过渡期中受益。
6.MDD证书所涵盖的附录XVI产品的MDR中规定的过渡期是什么?是否有需要满足的条件?
高风险产品(所有III类器械和IIb类植入式器械,缝合线,吻合钉,牙科填充物,正畸托槽,牙冠,螺钉,楔子,板,金属丝,针,夹子和连接件除外)的期限于2027年12月31日结束,低风险产品(排除在高风险组之外的所有其他类别和器械)的期限至2028年12月30日结束。
并非MDD证书涵盖的所有产品都有资格从MDR制定的过渡条款中受益,除非以下条件适用:
如果MDD证书从2017年5月25日起颁发,在2021年5月26日仍然有效,之后没有被撤回,并且在2023年3月20日之前到期,则只有满足MDR Article 120(2)(a)或(b)点中规定的条件之一,受保产品才能受益于MDR过渡条款;
如果MDD证书从2017年5月25日起颁发,在2021年5月26日仍然有效,之后没有被撤回,并且在2023年3月20日之前没有过期,则涵盖的产品可以从MDR过渡条款中受益。
MDR Article 120(3c)(3d)(3e)款规定了必须满足的附加条件和要求,才能受益于并继续受益于过渡条款。关于这些具体条件的更多信息,请参阅关于实施条例(欧盟)2023/607的问答文件。
7.MDD证书所涵盖的附录XVI产品的CS中规定的过渡期是什么?是否有需要满足的条件?
高风险产品(所有III类器械和IIb类植入式器械,缝合线、吻合钉、补牙、牙套、牙冠、螺钉、楔块、板、线、针、夹子和连接器除外)的期限约为4.5年,低风险产品(排除在高风险组外的所有其他类别和器械)的期限约为5.5年。它从2023年6月22日开始,到2027年12月31日或2028年12月30日结束。
并非MDD证书涵盖的所有产品都有资格从CS制定的过渡条款中受益。事实上,只有当MDD证书从2017年5月25日起颁发,在2021年5月26日仍然有效,之后没有撤回,在2023年3月20日之前到期,并且不满足第120(2)条第二款a)或b)点中规定的条件时,这些规定才适用。
在过渡期间,需要满足额外的条件和要求。下表列出了在过渡期内继续投放市场或投入使用产品所需满足的每一个条件。
表3:根据CS第2(3)条的过渡条款的适用条件
为了确定条件和要求,CS参考了MDR Article 120(3c)(3d)和(3e)款。经法规(EU)2023/607修订的MDR过渡条款的问答文件提供了额外的有用信息。
必须注意的是,涵盖受益于CS制定的过渡条款的产品的MDD证书的有效期不会延长。尽管如此,这些产品也可以在MDD证书到期日后投放市场或投入使用,直到过渡期结束。
8.CS中规定的MDD证书所涵盖的附录XVI产品的过渡期在2023年6月22日之前适用?是否有需要满足的条件?
MDD证书所涵盖的附录XVI产品的过渡期在CS中规定,之后由实施条例(EU)2023/1194对其进行了修订。这些过渡条款在2022年12月22日至2023年6月21日期间仍然适用。
在修订前,CS订明须符合的条件,以便受惠及继续受惠于过渡条文。这些条件包括产品需要继续符合MDD的要求,但有效MDD证书所涵盖的要求除外,该证书在2021年5月26日后到期;需要避免产品的设计和预期用途发生重大变化;制造商需要与公告机构签署书面协议,以便进行适当的监督。经实施条例(EU)2023/1194修订的CS中保留了这些条件。这些条件的兼容性确保了从2023年6月22日起顺利过渡到适用的新制度。
9.含有药品的产品的过渡期是什么?
附录XVI产品没有具体的过渡条款,如果这些产品包含一种可以单独使用的物质,它将被视为2001/83/EC指令第1条第2点中定义的医药产品。在这种情况下,成员国根据指令2001/83/EC或EMA指定的主管机构协商的210天的时间段必须被视为CS授予的过渡期的一部分,以防公告机构参与产品的符合性评估程序。
10.两用器械的过渡性规定是什么?
对于具有医疗和非医疗预期用途的两用器械,必须同时满足MDR和CS的适用要求。针对过渡条款,对于医疗目的而言,MDR Article 120条适用,而对于非医疗目的,CS适用。考虑到器械必须同时满足MDR和CS的适用要求,如果这些要求不同,例如在设定过渡期结束时,应考虑并满足更严格的要求。
11.制造商如何证明他们的产品从过渡期中受益?
制造商应能够提供一份自我声明,确认符合从过渡条款中受益的条件,并说明过渡期的结束日期。一旦新条件适用并得到满足,应立即更新自我声明。
自我声明应明确说明所涵盖的产品,并可基于统一的模板。
一旦与公告机构签署符合性评估书面协议的条件适用,可通过公告机构发布的“确认函”提供额外证据,说明收到制造商的符合性评估申请以及达成书面协议。此类确认应明确确定所涵盖的产品,可基于统一模板,原则上无需额外费用即可发布。
如果MDD证书涵盖了产品,则自我声明和确认函应列出相关产品及其证书参考。关于MDD证书所涵盖产品的其他信息,请参阅关于实施法规(EU)2023/607的问答文件(见问题7)。
12.在过渡期内,是否需要向市场提供产品的最后期限?
不需要。将过渡期标记在产品上的产品也可以在适用的过渡期结束后进一步提供给市场。
13.在过渡期内,公告机构是否可以为MDR下的附录XVI产品颁发证书?
可以。公告机构可在2023年6月22日(CS申请日期)起的过渡期内为MDR下的附录XVI产品颁发证书。在此之前,MDR不适用于附录XVI的产品,因此公告机构无法颁发任何证书。