今日头条
江苏新元素痛风新药上国际临床。江苏新元素医药URAT1抑制剂ABP-671用于治疗痛风的国际关键临床首例患者入组。该项试验在美国、欧洲、拉丁美洲和亚太多个国家开展,旨在评估ABP-671在不同剂量和给药方案下的安全性和有效性。ABP-671已在中国Ⅱa期试验中获得积极结果,每天一次ABP-671(1mg)治疗可使86%的患者血清尿酸(sUA)水平低于6mg/dL;研究结果与此前在澳大利亚开展的Ⅱa期试验结果一致。
国内药讯
1.绿叶长效帕利哌酮美国报产。绿叶制药自主研发的第二代抗精神病长效针剂棕榈酸帕利哌酮缓释混悬注射液(LY03010)在美国通过505(b)(2)的途径向FDA提交新药上市申请(NDA),用于治疗精神分裂症和分裂情感性障碍。去年11月,LY03010在美国开展的关键临床(Invega Sustenna)达到预期终点,与对照药的初始给药方案相比,LY03010在多次给药达到稳态的生物等效性。
2.康宁杰瑞HER2双抗ADC启动III期临床。康宁杰瑞HER2双抗ADC药物JSKN003(KN026-ADC)登记启动一项III期临床,拟评估JSKN003对比研究者选择化疗治疗HER2低表达复发或转移性乳腺癌的有效性和安全性。该项试验主要研究者由中山大学孙逸仙纪念医院医学博士宋尔卫和复旦大学附属肿瘤医院医学博士吴炅共同担任。JSKN003已在治疗HER2表达实体瘤的澳洲I期和中国I/II期临床获得积极结果,详细数据将在今年12月份举办的SABCS会议上公布。
3.杭州格博新型分子胶获批临床。杭州格博生物新型分子胶降解剂GLB-002胶囊获国家药监局临床试验默示许可,拟开发用于治疗血液肿瘤,包括非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM)等。GLB-002具有全新化学母核结构的CRBN E3连接酶调节剂(CELMoDs),旨在通过与CRL4CRBNE3连接酶CRBN相结合,促使转录因子IKZF1(Ikaros)和IKZF3(Aiolos)的泛素化,继而被蛋白酶体降解,激活多种抗肿瘤的下游反应,最终对NHL和MM等血液肿瘤发挥治疗作用。
4.博锐SIRPα单抗获批美国临床。博锐生物自主研发的SIRPα单抗BR105注射液获FDA批准在美国开展临床试验。BR105能识别SIRPα的常见基因型,并阻断SIRPα与其配体CD47的互相作用,解除“别吃我”信号,激活巨噬细胞发挥肿瘤吞噬作用,实现抗肿瘤免疫治疗。在国内,BR105正在I期临床中评估治疗晚期恶性肿瘤患者的安全性、耐受性、抗肿瘤活性。
5.百利天恒EGFR/HER3双抗美国获批肺癌临床。四川百利天恒药业自主研发的HER3/EGFR双抗SI-B001(izalontamab)获FDA临床许可,拟联合多西他赛开展治疗非小细胞肺癌的临床试验。今年6月,该产品在中国登记启动一项III期临床,评估与多西他赛联合治疗对比多西他赛二线治疗局部晚期或转移性无驱动基因变异的非小细胞肺腺癌和肺鳞癌患者的有效性和安全性。在II期研究中,SI-B001联合化疗的客观缓解率达到31.3%。
6.禾元生物第三代溶栓药获批临床。禾元生物利用其水稻胚乳细胞生物反应器高效重组蛋白表达平台(OryzHiExp)开发的植物源重组瑞替普酶(简称OsrPA)获国家药监局临床试验默示许可,拟开发用于成人由冠状动脉梗塞引起的急性心肌梗塞的溶栓治疗,改善心肌梗塞后的心室功能。OsrPA可使纤维蛋白溶解酶原激活为有活性的纤溶蛋白溶解酶,以降解血栓中的纤维蛋白,发挥溶栓作用。
国际药讯
1.诺和诺德PH1小核酸RNAi疗法获批上市。诺和诺德以33亿美元收购Dicerna公司获得的RNAi疗法nedosiran获FDA批准上市,用于治疗1型原发性高草酸尿症(PH1)。在关键II期PHYOX™2临床中,与安慰剂相比,nedosiran著性降低PH1亚型患者的尿液中草酸盐排泄(Uox)量;而且nedosiran组患者达到并维持正常、或接近正常Uox的比例显著更高(50%比0%, p=0.0025)。
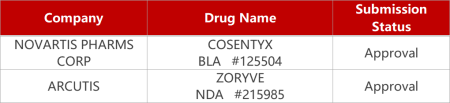
2.罗氟司特乳膏获FDA扩展用于儿童。Arcutis公司基于HydroARQ递送技术开发的4型磷酸双酯酶(PDE4)抑制剂Zoryve(roflumilast,0.3%)乳剂获FDA批准补充新药申请,用于6-11岁儿童斑块状银屑病的局部治疗。此前,该新药已被批准用于治疗12岁以上斑块状银屑病患者。在临床研究MUSE中,Zoryve在6-11岁斑块状银屑病患者中的药代动力学、安全性、耐受性和疗效数据与Ⅲ期临床(DERMIS-1和DERMIS-2)成人中的数据基本一致。
3.默沙东PD-1抑制剂膀胱癌Ⅲ期临床积极。默沙东PD-1抑制剂Keytruda用于辅助治疗局部肌层浸润性尿路上皮癌(MIUC)和局部晚期尿路上皮癌患者的Ⅲ期AMBASSADOR(KEYNOTE-123)试验达到无病生存期(DFS)主要终点。独立数据监测委员会评估的中期分析显示,与手术后仅接受观察的患者相比,Keytruda辅助治疗显著改善患者的DFS;临床中未发现新的安全性信号。目前,该试验正在继续评估另一项主要终点(总生存期)。
4.CRF1拮抗剂CAH儿科Ⅲ期临床成功。Neurocrine公司选择性促肾上腺皮质激素释放因子1型受体(CRF1)拮抗剂crinecerfont,在治疗经典先天性肾上腺皮质增生症(CAH)的Ⅲ期CAHtalyst儿科研究中达到主要和关键次要终点。与安慰剂相比,crinecerfont治疗显著降低患者第4周时的血清雄烯二酮水平;显著降低患者第28周时每日所需糖皮质激素剂量百分比(p<0.0001)。该项试验结果与Ⅲ期CAHtalyst成人研究的结果一致。Neurocrine计划明年向FDA和EMA递交其上市申请。
5.诺华FIC补体疗法IgA肾病III期临床积极。诺华潜在“first-in-class”补体因子B抑制剂iptacopan治疗IgA肾病的III期APPLAUSE-IgAN研究结果积极。与安慰剂相比,iptacopan(200mg)治疗显著减少患者蛋白尿,其安全性数据与先前研究一致。诺华计划基于中期数据向FDA寻求加速批准上市。目前,该新药也正在多项关键研究中评估用于C3肾小球病(C3G)、非典型溶血性尿毒症综合征(aHUS)、膜性肾病(MN)、狼疮性肾炎(LN)等治疗潜力。
6.BMS以48亿美元收购Mirati公司。百时美施贵宝宣布与Mirati Therapeutics达成最终合并协议,将以每股58美元的现金收购后者,总股本价值为48亿美元。此次收购,百时美施贵宝将获得Mirati公司重磅肺癌治疗药物KRAS G12C抑制剂Krazati(adagrasib),以及多款创新产品包括RTK抑制剂Sitravatinib、PRMT5抑制剂MRTX1719、SOS1抑制剂MRTX0902和KRAS G12D抑制剂MRTX1133。2022年12月,Krazati已获FDA加速批准上市,再鼎医药拥有其在大中华区的权益。
医药热点
1.上海交大医学院骨科学院成立。10月8日,上海交通大学医学院骨科学院揭牌成立。国家骨科医学中心主任、上海交通大学医学院附属第六人民医院骨科学科带头人张长青教授任院长。据悉,上海交通大学医学院骨科学院主要是整合各附属医院的骨科学科资源,加强一体化建设,并依托上海交通大学5G、人工智能、大数据和云计算等新技术优势,促进学科交叉,建成国际一流骨科临床诊治研究中心、国内领先创新转化高地和示范区、骨科医学卓越人才培养重要基地。
2.华中干细胞库落户同济医院。近日,同济医院成为中国干细胞与再生医学协同创新平台成员单位,并获授牌华中干细胞库,成为华中地区首个干细胞库。华中干细胞库主要致力于人胚干细胞和人多能干细胞的制备、干细胞药物的开发和干细胞库的建立。为难治性疾病如脊髓损伤、脑外伤、早衰等提供再生医学新疗法,并围绕干细胞与再生医学开展科研工作,重点建设正常人和患者的多能干细胞库及工作库,干细胞临床前基础研究及转化研究等技术平台。
3.默克中国任命事业部新负责人。近日,默克宣布俞宇平将加入默克担任中国医药健康业务副总裁,心血管、代谢及内分泌 (CM&E) 事业部负责人。他将直接向中国医药健康董事总经理张巍汇报。俞宇平毕业于中国药科大学医药工商管理专业,同时拥有英属哥伦比亚大学工商管理硕士学位。在加入默克中国前,俞宇平就职于阿斯利康中国,历任公司渠道业务负责人、心血管肾脏代谢业务部产品线负责人、市场执行总监等职务。
评审动态
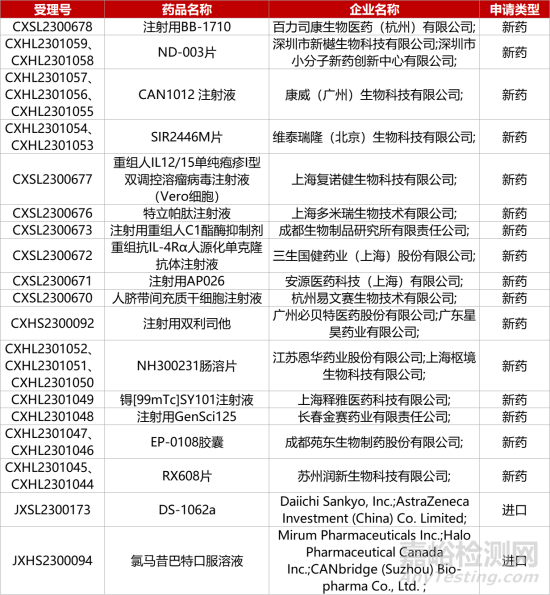
1. CDE新药受理情况(10月09日)
2. FDA新药获批情况(北美10月06日)