今日头条
英派PARP抑制剂卵巢癌Ⅲ期临床积极。英派药业PARP抑制剂senaparib用于维持治疗晚期卵巢癌患者的Ⅲ期FLAMES研究积极结果公布于ESMO2023大会上。与安慰剂相比,senaparib治疗显著改善患者的无进展生存期PFS,将疾病进展或死亡风险降低0.43%(95%CI:0.32-0.58; p<0.0001),而且与BRCA突变状态无关;两组患者3级不良事件(AE)的发生率分别为66.3%和20.3%。今年8月,CDE已受理该产品的新药上市申请。
国内药讯
1.百济神州PD-1单抗两项Ⅲ期临床积极。百济神州PD-1抑制剂替雷利珠单抗在ESMO2023大会上公布用于治疗晚期胃或胃食管结合部腺癌和非小细胞肺癌的两项Ⅲ期研究(RATIONALE-305试验和RATIONALE 315)积极结果。在RATIONALE-305试验中,替雷利珠单抗联合化疗相比化疗显著改善PD-L1高表达的患者总生存期([中位OS:17.2vs12.6个月;HR0.74;P=0.0056]);在意向性治疗(ITT)人群中,联合治疗也显著改善患者OS(中位OS:15.0vs12.9个月);并且药物耐受性良好。
2.兴盟狂犬病毒单抗组合制剂最新数据积极。兴盟生物泽美洛韦玛佐瑞韦单抗注射液(SYN023,克瑞毕)用于狂犬病毒暴露后被动免疫治疗的最新临床数据公布于美洲狂犬病会议上。与人狂犬病免疫球蛋白(HRIG)相比,SYN023(0.3mg/kg)注射第七天,显著提高受试者体内狂犬病毒中和抗体(RVNA)水平提升至≥0.5IU/mL的比例;随访1年期间,没有严重不良反应事件发生。
3.挚盟钾离子通道剂获ALS孤儿药资格。挚盟医药自研KCNQ2/3钾离子通道开放剂CB03获FDA孤儿药资格,用于肌萎缩侧索硬化(渐冻症,ALS)患者的治疗。CB03具有较好的离子通道选择性、化学和代谢稳定性、抗神经过度兴奋等活性,有望为ALS和其他CNS疾病患者提供新的治疗选择。目前,该新药正在澳大利亚健康受试者中开展的Ⅰ期临床评估。
4.华奥泰IL-36R单抗获GPP孤儿药资格。华海药业旗下华奥泰生物IL-36R单抗HB0034注射液获FDA授予孤儿药资格,用于治疗泛发性脓疱型银屑病(GPP)。HB0034能特异性结合IL-36R,阻断IL-36炎症通路信号,已在临床前研究中显示出可显著抑制咪喹莫特(IMQ)诱导的食蟹猴皮肤红斑、皮屑及增厚的银屑病样症状,而且安全耐受性良好。去年7月,NMPA已批准HB0034在国内开展Ⅰb期临床研究。
5.九天AAV眼科基因疗法国内获批临床。九天生物AAV眼科基因治疗药物SKG0106眼内注射溶液获国家药监局临床许可,拟开发用于治疗新生血管性年龄相关性黄斑变性(nAMD)患者。SKG0106携带编码独特的抗VEGF蛋白的转基因序列,通过单次玻璃体腔注射后在眼内高效转导视网膜细胞表达抗VEGF蛋白,以抑制VEGF生物活性并阻断眼内新生血管增生。今年7月,该新药已获FDA批准开展针对nAMD的全球I/IIa期临床。
6.翰森B7-H4靶向ADC授权GSK。翰森制药旗下翰森生物与葛兰素史克附属公司GlaxoSmithKline订立许可协议,授予后者在全球(不含中国大陆、香港、澳门及台湾地区)开发、生产及商业化新型B7-H4靶向ADC药物HS-20089,用于治疗晚期实体瘤患者。根据协议,翰森生物将获得8500万美元首付款,最多14.85亿美元的里程碑潜在付款,以及产品的销售分成。
国际药讯
1.辉瑞五价脑膜炎球菌疫苗获批上市。辉瑞脑膜炎球菌疫苗Penbraya获FDA批准上市,用于预防10至25岁人群中5种最常见血清群引起的脑膜炎球菌病。临床数据显示,2剂Penbraya与对照组疫苗(2剂Trumenba+1剂Menveo)相比,受试者在所有5个血清型中的免疫反应皆呈非劣效性;与单剂Menveo相比,单剂Penbraya疫苗在对A、C、W、Y血清型的免疫反应上亦呈现非劣效性。
2.O药皮下剂型肾透明细胞癌III期临床成功。百时美施贵宝PD-1抑制剂纳武利尤单抗(Opdivo)皮下注射制剂对比其静脉注射制剂用于晚期或转移性肾透明细胞癌(ccRCC)经治患者的III期CheckMate-67T研究达到共同主要终点和关键次要终点。与静脉制剂相比,其皮下制剂第28天时的时间平均血清浓度(Cavgd28)和稳态时的谷血清浓度(Cminss)、以及客观缓解率的统计均达到非劣效性。详细数据将在医学会议上公布。
3.阿斯利康PD-L1消化道肿瘤Ⅲ期临床积极。阿斯利康PD-L1抑制剂Imfinzi联合标准新辅助化疗,治疗可切除、早期和局部晚期(II期、III期、IVA期)胃癌和胃食管连接部(GEJ)癌的Ⅲ期试验MATTERHORN结果积极。与单独新辅助化疗相比,Imfinzi联合新辅助化疗显著提高BICR评估的病理完全缓解(pCR)率(19%vs7%,p<0.00001);两组完全缓解或接近完全缓解率分别为27%和14%;药物安全性良好。
4.安进DLL3/CD3双抗肺癌Ⅱ期临床见刊NEJM。安进DLL3/CD3双特异性T细胞结合器(BiTE)tarlatamab治疗晚期小细胞肺癌(SCLC)经治患者的Ⅱ期研究成果发表于NEJM上。中位随访为10.6个月时,tarlatamab(10mg)达到40%(97.5% CI:29,52)的客观缓解率;患者中位无进展生存期为4.9个月(95% CI:2.9,6.7),中位总生存期为14.3个月(95% CI:10.8,NE);临床中未观察到新的安全性信号。
5.创新PD-1/LAG-3双抗早期临床结果积极。MacroGenics公司PD-1/LAG-3双特异性抗体tebotelimab治疗晚期或转移性实体瘤和血液肿瘤的Ⅰ期临床结果积极。在剂量递增队列中,tebotelimab单药达到34%的临床缓解率;治疗相关不良事件发生率为68%,其中有22%为≥3级;推荐的Ⅱ期剂量为每2周一次600mg。此外,在抗HER2/抗PD-1联合治疗耐药的患者中,tebotelimab联合margetuximab治疗的确认客观缓解率为19%。
6.默沙东220亿美元引进第一三共3款ADC。默沙东与第一三共就后者三款DXd抗体偶联药物(ADC)候选药物patritumab deruxtecan(HER3-DXd)、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)达成合作许可协议,获得三款候选产品除日本以外的全球开发和商业化授权。根据协议,第一三共将获得45亿美元预付款、10亿美元的研发费用相关可退还预付款,以及最高165亿美元的商业里程碑金额,协议总金额高达220亿美元。
医药热点
1.中国中医科学院大学苏州校区封顶。近日,苏州市位于吴中高新区临湖镇的中国中医科学院大学(东区)项目所有主体结构施工完成,提前完成结构封顶。中国中医科学院大学项目为国家级大学,项目占地面积约40.67万平方米,总建筑面积约32.17万平方米。项目建成后将为苏州中医药行业带来顶级科研平台及医疗教学资源,助力苏州市成为江苏乃至长三角地区和全国中医药改革发展的重要基地。
2.国家规范化疼痛诊疗中心成立。近日,国家规范化疼痛诊疗中心在北京大学人民医院揭牌成立,旨在通过人才培养和临床支持等措施,推动我国优质疼痛医疗资源下沉基层。国家规范化疼痛诊疗中心成立后,预计将在全国协助建设20至30家县(市、区)级医疗机构规范化疼痛诊疗中心。下一步,国家规范化疼痛诊疗中心将先对已报名的30家基层医院进行调研评估,成立专家团,制订标准化培训计划,拟于2024年完成10到15家基层医院规范化疼痛诊疗中心的建设工作。
3.《居家养老上门服务基本规范》发布。近日,《居家养老上门服务基本规范》国家标准(GB/T43153-2023)正式发布,这是我国针对居家养老上门服务发布的首个国家标准,将为合理界定居家养老上门服务范围、规范供给主体资质条件及供给流程内容要求等提供基本依据。文件中主要专业化服务内容涵盖了居家养老所需的包括生活照料、基础照护、健康管理、探访关爱、精神慰藉、委托代办、家庭生活环境适老化改造等7项服务。
评审动态
1. CDE新药受理情况(10月21日)
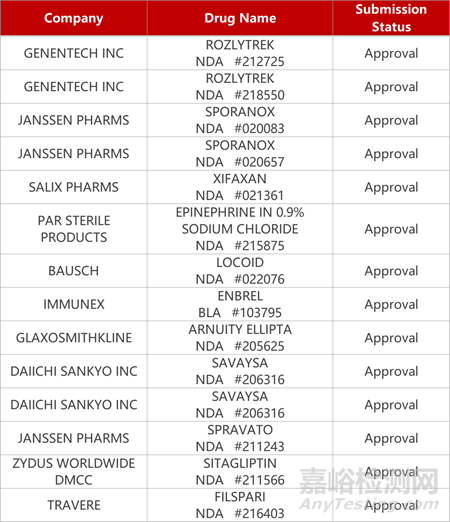
2. FDA新药获批情况(北美10月20日)