申请人在PNDA或者更早的关键临床开始前的沟通交流中,需要讨论起始物料的指认及相关的质量标准要求。申请人有详细的起始物料研究数据,包括质量标准设定依据的数据。相关杂质的限度设定与原料药的要求是否一致,一个判断关键点是起始物料中的杂质在生产合成过程中是否会影响到后继步骤产品的质量标准。
IND相关问题
问题1: 一个原料药的合成工艺中用到了乙苯,请问在成品中乙苯的限度应该如何制定?查询了该物质不属于常见残留溶剂的清单?
A:对于没有收入在ICH Q3C中的溶剂,可以查一下它的安全数据,最好来源权威,比如欧洲或美国相关的数据库,根据相关公式计算它的限度,与0.10%比较,取较严的限度。比如,只有LD50的化合物,可以使用LD50*50/2000计算NOEL,再根据PDE的公式换算为人体,计算得到PDE。最后得到的限度建议与官方沟通交流,得到同意,达成一致。
问题2:片剂4条溶出曲线,方法学验证时,耐用性是不是都要做?还是不做耐用性,不考察不同的溶出仪。
A:溶出曲线选择在方法开发里面研究,不需要做验证。我们做过的IND/NDA项目没有做验证,审批老师没有提出意见,最终还是根据项目的要求来做相关的验证。
问题3:有没有遇到气相色谱条件为柱温是程序升温,流速也不是恒定的?
A:气相色谱有两种模式,流速恒定和压力恒定。根据方法的需求设定。
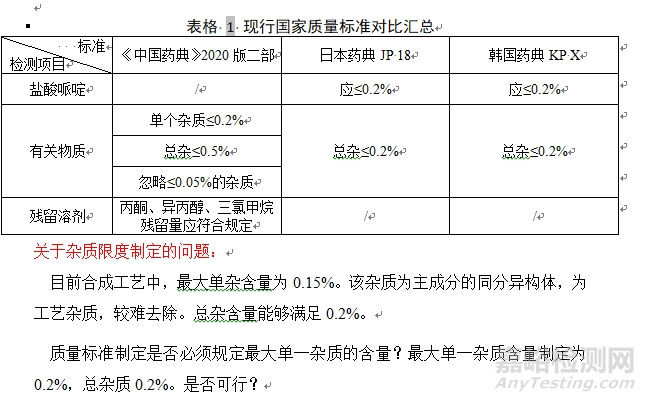
问题4: 下面案例中,仿制药单个杂质的限度依据是什么?Q3A不包括异构体,总杂必须按照全球最严吗?
A:位置异构是重点关注的,理论上作为特定杂质控制<0.15%,同时,这个杂质应该从源头控制。建议从工艺去控制这个杂质,按照ICHQ3A去制定单杂限度。原研能低于0.1%,应该是由办法处理的。
问题5:我们是一款生物无菌注射制剂,在生产阶段所用的辅料里面有一款还未在CDE登记的新药用辅料,目前这个药用辅料也是在IND阶段,现在工艺路线已经确定了,也生产一批工程批,但是是在非GMP条件下生产的,只有最后一步是在GMP条件下无菌过滤分装的。为了赶项目进度,目前考虑用这一批工程批去做新药用辅料的毒理研究和制剂的毒理批以及验证三批生产是否可行?在申报IND阶段,制剂的验证三批是否一定要用GMP批次的的药用辅料?
A:毒理批次可以使用非GMP物料的。临床批次是需要在临床使用,因此需要使用GMP批次的原料药和辅料。
问题6:有见过中美欧有关于起始物料合成步骤至少需要3步的要求吗?
A:一般会有要求三步或者以上,主要参考Q11,但不代表三步就一定可以,取决于指定的起始物料的风险大小,也有五步的。EMA有一个关于起始物料选择的反思文件。
问题7:请问改良新药的preIND会议,有可能按照二类会议吗?
A:可以按二类会议申请。
问题8:请问,沟通交流会议PPT提交上去后,还能修改吗?
A:一般没有修改的计划,除非开会,会有更新和补充的机会。如果修改理由充分且必要,和对接老师说清楚,并要求开通上传路径。
问题9:IND阶段,晚期肿瘤药物没做遗传毒性试验,其基因毒杂质需要控制在0.15%以内吗?
A:基因毒杂质参照M7指导原则,先判断是几类基杂,然后再计算限度要求。晚期肿瘤适应症的致突变杂质控制策略可以参照ICH S9,实际可以根据ICH Q3A/B来控制的。
问题10:制药用水通则里的注射用水和灭菌注射用水,用途里都写了可以用作注射剂的稀释剂,灭菌注射水还可用在冻干粉的溶剂,如果本身制剂就是液体,是不是制剂工艺中原料药用注射用水溶解就可以了,后面进行灭菌?
A:我之前理解的注射用水就是无菌的,所以当时看到非临床试验报告用的都是灭菌注射用水还有点疑惑。一般生产上用的注射用水都是温度控制在80℃以上或4℃以下保温循环,市售的灭菌注射用水则是在注射用水基础上进行了包装和终端灭菌。
问题11:临床试验期间,辅料供应商变更,属于一般变更还是重大变更?
A:参考临床实验期间变更指南评估。不影响产品质量,不影响受试者安全性,一般可以评估为一般变更。自己要做一下评估,外用制剂要考虑制剂的功能性等是否有受影响。自己内部企业需要有个变更评估。
问题12:原辅包不登记是否也可以用于临床试验?
A:未登记的原辅包,在提交IND申报资料时,需提供原料药、药用辅料及药包材合法来源证明文件,包括供货协议、发票等。
问题13:关键临床试验用的制剂批次,有批量要求么?是不是可以少于10w片?
A:关键临床的批量最好和商业化批量一致。三期之前最好和CDE开一次药学会议,商议产品的批量。
问题14:知道LD50怎么计算NOEL值,有没有权威的计算方式?
A:有文献是这样使用的,NOEL=LD50*50kg/2000,关键这个算法得到的限度需要与官方沟通交流确可。
问题15:申报IND的时候,原料药的资料可以直接不登记,但是由原料药厂家将光盘寄给CDE吗?
A:可以的。
问题16:想问下植物提取液可以作为半合成原料药的起始物料吗?
A:如果可以保证的情况下,以植物提取浓缩液而不是源植物作为半合成原料药的起始物料是可以的,与CDE沟通交流这种情况非常重要。
问题17:临床试验是不是可以多个持有人共同申报?
A:IND阶段可以有多个申请人一起,我们有过,NDA阶段不可以。
问题18:请问注射剂配伍微生物挑战试验,关于试验菌种的选择确定有什么参考文件不?
A:一般是选医院环境中常见的菌种。超过4个小时的要做,不超过的不用做。
NDA相关问题
问题19:不定入最终质量标准的检测项目,大家都是在QC实验室做验证吗?还是在研发实验室做了研究提交积累的数据就可以。比如制剂对映异构体、晶型等分析方法。
A:可以在研发实验室做,考虑的点是研究数据符合研发现场核查即可。前提还是这些项目最终没有定入注册质量标准,如果还处在注册申报中,还是建议与放行测试一起收集数据。
问题20: 对于创新药不可接受的批次是什么?溶出度的重复性具体怎么做?重复性的限度多少?
A:不可接受的批次是指在某些工艺参数条件下生产得到的某些指标不符合质量标准的批次。溶出方法有一定的区分力,能区分这些质量不好的批次。溶出度重复性分溶出仪重复性(限度是RSD≤5%)和色谱条件重复性(RSD≤2%)。
问题21:如果委托官方的检测机构,进行原辅料检测,使用中国药典的方法,难道他们就可以不对方法进行确认了吗?
A:委托样品检测时,并没有委托方法确认,所以委托的范围要确认一下,收费不同的。
问题22:有见过已上市产品委托外检注册标准中的测试项目且用于产品放行吗?
A:常见,不是每个企业都能配备那些特殊的高精尖设备。但建议找有检测资质的第三方,仅限于个别项目。持有人需要审计委托的第三方。
问题23:同一生产商,原料药一样,处方不同、规格不同,申请不同的适应症,最后按照两个商品名上市,按照两个通用名称,可以么?
A:不可以,不同的剂型都是一个商品名。
问题24: NDA产品申请时,瓶装片剂这种需要研究使用稳定性吗?
A:需要的,一般两批做三个月。EMA有具体的使用中稳定性指南建议。
问题25:在注册申请审评期间工作程序有提及,如果是主体变更,时限不变;如果是技术变更,进行关联审评。如何在审评期间进行变更?
A:上市审评时,如果有重大的技术变更需要申报审评时,会有要求撤回NDA的可能性,重新进行NDA申报。
问题26:一般NDA阶段,起始物料和中间体中实际存在大于0.1%(日剂量小于2g)的杂质,都需要进行结构确认吗?质量标准可以定为未知单杂不得大于0.5%或者0.2%吗?前两年仿制药申报的时候这样定过,也通过了。
A:规定的是药品鉴定限,跟起始物料和中间体没什么直接关系。不过起始物料现在也有潜在规定,不大于0.2%,否则需要研究衍生杂质或者证明该杂质在后续反应中不参与反应并可以除去。
问题27:如果一个产品NDA先报适应症A,再报适应症B,如果适应症A申请已经做了注册检验,那么适应症B的NDA申请是不是就不用做注册检验了?
A:药学是一致的,可以直接说明M3一致,申请不审评药学 ,也就不用注册检验和现场核查。