导语:本篇内容为学习总结,源自审评三部刘文博老师关于《医美类植入性医疗器械的技术审评进展》的培训。包括背景、医美植入器械的品种及产品概况、审评过程中的关键问题及进展、医美产品的技术审评趋势和展望进行了介绍。本文主要针对医美植入性器械分类及注册情况,以及对安全有效性评价关键问题解析进行学习总结。
第一部分:医美植入性医疗器械分类及注册情况概述
公元前1223年,古埃及的法老拉美西斯二世因鼻子过大,死后将骨骼植入鼻子,这可能是最早的医疗美容案例,但并非应用于活体人体。公元前600年,我国春秋时期已有医生将患者脸颊和额头皮肤移植。根据《肘后备急方》记载,早在古时我国已有用鸡蛋清治疗面部瘢痕的方法。
一战期间,英国医生为受伤士兵实施面部修复手术。自90年代至今,医疗美容市场陆续推出微整形产品,如1992年全球首款医美级产品、激光脱毛设备以及玻尿酸等。近年来,玻尿酸产品已广泛应用于国内外市场,多家企业成功申报并获得注册证书。
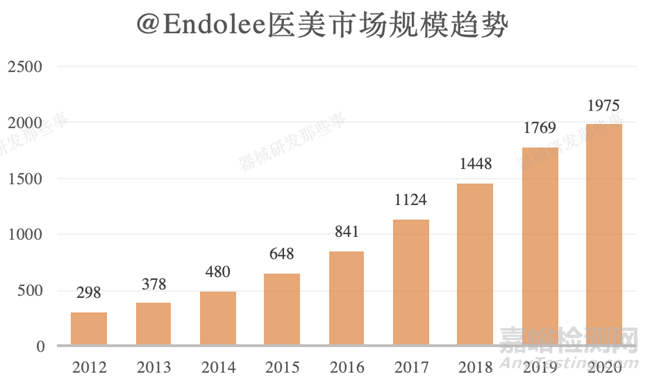
我们国家在2018年已经跃升为了世界第二大的医美的市场,我国2012年到2020年医美市场容量298亿元增张至1978亿元,2020年的容量是2012年的6.6倍,复合增长率23.4%。可见我国医美市场需求巨大。根据我国药监局的医疗器械分类目录,这类产品主要归类为13-09类(外科和整形外科)。
按照分类编码分为13-09-01(无源植入器械-整形及普通外科植入物-整形填充材料)、13-09-02(无源植入器械-整形及普通外科植入物-整形用注射填充物)、13-09-03(无源植入器械-整形及普通外科植入物-乳房植入物)、13-09-10(无源植入器械-整形及普通外科植入物-软组织扩张器)、13-09-00(无源植入器械-整形及普通外科植入物-面部埋植线/提拉线)四大类。其中13-09-02比较复杂一些,主要分为:
单一作用成分:透明质酸钠凝胶、胶原蛋白
含可吸收微球:聚乳酸PLA、聚己内酯PCL、左旋乳酸-乙二醇共聚物
含不可吸收微球:甲基丙烯酸甲酯PMMA、聚乙烯醇PVA
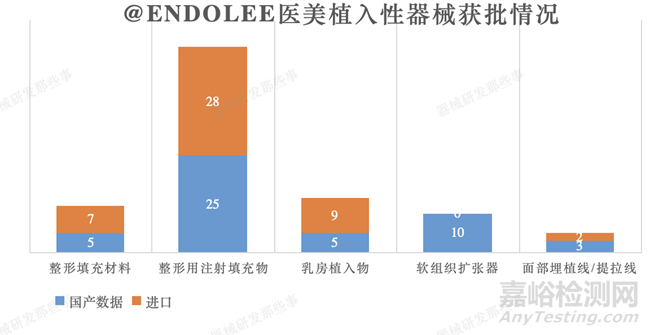
截止到培训时间2021年9月,其中,13-09-01(无源植入器械-整形及普通外科植入物-整形填充材料)产品一般采用聚四氟乙烯、硅橡胶、高密度聚乙烯等材料,国内批准了5个产品(上海4个,广州1个),另有7个进口产品(美国3个,韩国3个,巴西1个)。整形用注射填充物,目前已有25个国产产品和28个进口产品获得批准上市。乳房植入物获批国内5个,进口9个;软组织扩张器国内10个;面部埋植线/提拉线国内3个,进口2个。
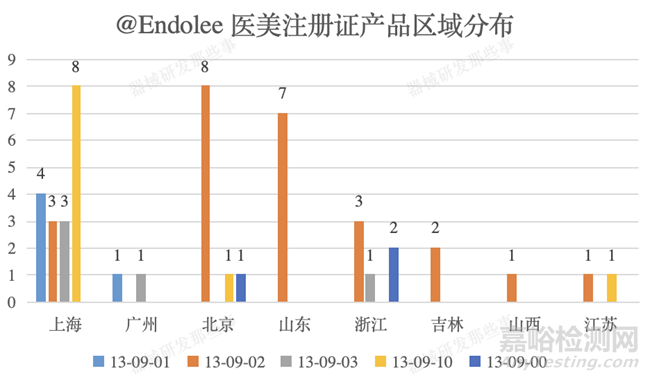
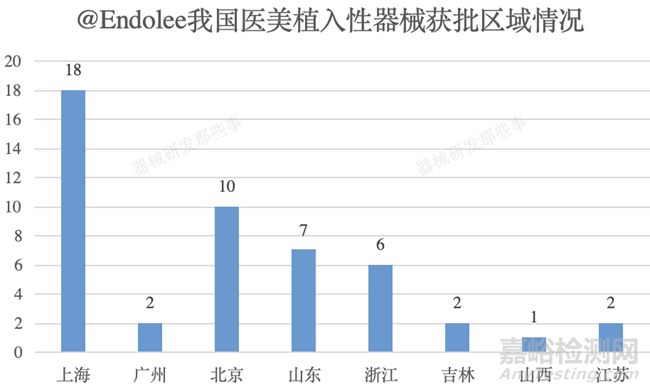
截止培训时间,国产医美类植入性器械共计获批48个,同时不难发现国内主要集中在上海(18个)、北京(10个)、山东(7个)和浙江(6个)等地。
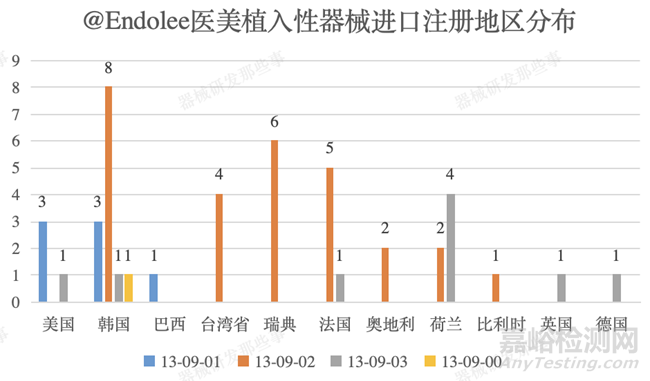
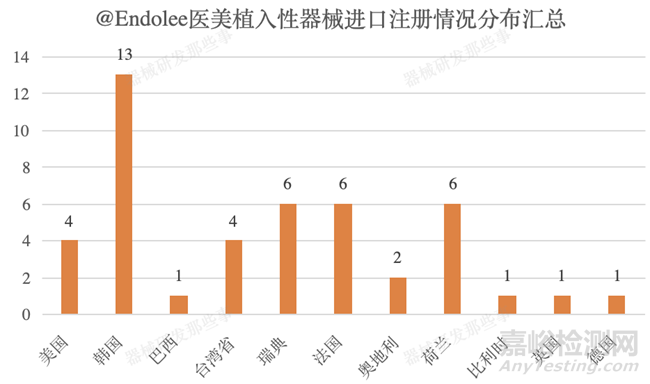
截止培训时间(2021年9月)医美植入性器械进口注册共计获批45个,主要集中在韩国(13个)、瑞典(6个)、法国(6个)、荷兰(6个)、美国(4个)及台湾省(4个)。
第二部分:医美植入性医疗器械安全有效性评价关键问题解析
在接下来的内容中,我将重点介绍近年来器审中心审评的医美类产品的安全和性能评价的关键问题,并对此进行探讨。在此之前我们首先看下相关的医疗器械指导原则或国家行业标准【在公众号内容回复 医美 获得医美相关指导原则或标准包(11个文件)】,主要包括:
医疗器械指导原则或审评要点
乳房植入体产品注册技术审查指导原则
透明质酸钠类面部注射填充材料注册技术审查指导原则
透明质酸钠类面部注射填充材料临床试验指导原则
整形用面部植入假体注册技术审查指导原则
整形美容用重组人源化胶原蛋白注射材料技术审评要点
相关国家标准/行业标准
YY 0647/ISO 14607 无源外科植入物 乳房植入物的专用要求
YY0334 硅橡胶外科植入物通用要求
YY/T 0484 外科植入物双组分加成型硫化硅橡胶
YY 0954 无源外科植入物I型胶原蛋白植入剂
YY/T 0962 整形手术用交联透明质酸钠凝胶
YY/T 1888-2023 重组人源化胶原蛋白
YY/T 1555.2-2018 硅凝胶填充乳房植入物专用要求 硅凝胶填充物性能要求 第2部分:可浸提物质限量要求
YY/T 1555.1-2017 硅凝胶填充乳房植入物专用要求 硅凝胶填充物性能要求 第1部分:易挥发性物质限量要求
首先,第一个关键问题就是关于注射植入剂产品的使用范围的扩充。长期以来,这类产品的使用范围仅局限于单一的皱纹矫正等,这主要是因为注射整形的医生对产品超适用范围的灵活应用,以及申请人没有动力去申报更多的使用范围。举例如下:
鼻唇沟皱纹 举例:注射用修饰透明质酸钠凝胶
注册证号:国械注准20173463254
适用范围:该产品适用于面部真皮组织中层至深层注射以纠正中重度鼻唇沟皱褶。
额部皱纹 举例:重组III型人源化胶原蛋白冻干纤维
注册证号:国械注准20213130488
适用范围:用于面部真皮组织填充以纠正额部动力性纹(包括眉间纹 额头纹和鱼尾纹)。
颈部皱纹 举例:注射用透明质酸钠复合溶液
注册证号:国械注准20163461804
适用范围:该产品用于皮内真皮层注射填充,以糾正颈部中重度皱纹。
改善面部轮廊-中面部 举例:注射用修饰透明质酸钠凝胶
注册证号:国械注进20203130098
适用范围:适用于注射到皮下至骨膜上层用于矫正中面部。
隆鼻 举例:整形用胶原和PMMA皮下植入物系统
注册证号:国食药监械(进)字2012第3460540号(更)
适用范围:该产品用于注射到真皮深层以糾正鼻唇沟纹,或填充到骨膜外层以进行(鼻骨段)隆鼻。
改善手部外观 举例:注射用交联透明质酸钠凝胶
注册证号:国械注进20193130625
适用范范围:该产品适用于18岁以上手背部需要增加组织容量的人群,用于手背部真皮层,最佳为真皮深层的注射,以改善手部皮肤外观。
丰唇举例:含利多卡因注射用交联透明质酸钠凝胶
注册证号:国械注进20213130109
一适用范国:该产品通过注射至唇红体和唇紅缘的唇粘膜、真皮浅层或中层,以矫正唇部不对称,轮廊畸形和容积缺陷等结构缺陷。
然而,近年来,随着我国对医美类医疗器械的规范使用,以及资本的推动,越来越多的产品开始申报更多的使用范围。例如,审评的产品中,有的用于纠正唇部皱纹,有的用于矫正额部皱纹,有的用于填充中面部容量缺失和轮廓缺陷,有的用于隆鼻和手部外观改善等。
截止2021年9月国内未批准的适用范围:
面部年轻化:补水、紧致 ;抗衰 ;提亮肤色
面部增容整形:额部增容(天庭饱滿) ;颏部增容(下巴)
隆胸、丰臀
头皮维护、脱发
私密整形
在审评以及产品设计开发过程中,需要关注产品的安全性、有效性、质量可控性等多个方面,确保产品的安全性和有效性。对于使用范围扩充的产品,我们需要重新评估其安全性、有效性以及质量可控性,确保其在新的使用范围下的安全性和有效性。
除了产品的使用范围扩充,我们还需要关注其他类型的产品,如含有可吸收聚酯微球凝胶的产品(主要特点为:可吸收聚酯微球降解速率较慢,可延长镇充效果)。获批的几个产品注册证号分别为:国械注准20213130460、国械注进20213130100、国械注准20213130276。这类产品在市场上引起了很大的关注,被称为“少女针”或“童颜针”。
在审评或设计开发过程中,我们需要关注其成分、降解周期及代谢途径、凝胶粒径分布、微球粒径分布、微球材料亲疏水性能、表面稳定性(微球悬浮和均匀分散均匀性和稳定性研究)、微球吸水性、填充剂复溶、组织相容性等多个方面,确保产品的安全性和有效性。
此外,我们还需要关注乳房植入体的界面性大细胞淋巴瘤问题。对于这类产品,我们需要提供关于BIA-ALCL的风险分析和防范措施相关的资料,并在产品上市或延续注册时提供相关的质量分析报告,加强远期临床随访,搜集相关信息,进行风险收益评价。具体建议如下:
乳房植入体大细胞淋巴瘤向题:间变性大细胞淋巴瘤BIA-ALCL关注点
建议申请人提供关于BIA-ALCL的风险分析和防范措施相关资料。
建议申请人在说明书中增加BIA-ALCL的相关警示信息,在所提供研究资料基础上按照YY 0647的要求明确乳房植入体预期寿命的信息,
在产品境外上市临床随访数据或延续注册产品质量分析报告的审评中需关注BIA-ALCL相关不良事件和投诉信息。
建议申请人上市后持续加强远期的临床随访,收集BIA-ALCL数据,并随时进行风险 受益评价。
鉴于目前的临床数据显示使用毛面植入体BIA-ALCL发病率更高,因此在审评中需考虑植入体表面特性对于产品安全性评价的影响,包括:
(1)在生物相容性评价中,建议申请人将植入体表面特性作为重要的考虑因素对所选取样品的代表性进行充分论证,尤其是植入、免疫毒性、生殖毒性、慢性毒性、致癌等项目。鉴于BIA-ALCL发病机理尚不明确,暂不宜强制要求对不同表面的产品分别试验,建议申请人按照GB/T 16886原则予以评价;
(2) 应对不同表面特性的植入体分别临床评价。
结束语:综上本篇学习总结,总的来说,在审评医美类产品时,我们需要关注产品的安全性、有效性、质量可控性等多个方面,以确保产品的安全性和有效性。同时,我们也需要关注产品的使用范围、新型材料以及与其他医疗器械的兼容性等问题,以满足市场需求和保护患者权益。