国内自2020年开展医疗器械带量采购以来,企业陆续瞄准海外市场,医疗器械急需出海。海外CE认证正处在MDR过渡末期,将影响已出海的医疗器械合法合规销售,同时MDR法规更加重视数据的透明度和可追溯性,且上市后监管更加严格。
在此背景下,真实世界数据支持医疗器械出海的优势日益凸显。真实世界研究(Real-World Study,RWS)是在真实世界环境中进行的研究。RWS通常使用现有的医疗记录、病历等,以便更好地了解医疗干预的效果和安全性。
相比RCT,RWS可以提供更广泛的参与者、更长的跟踪时间、更真实的结果,并且可以更好地反映真实世界中的医疗实践。同时,有研究表明RWS也更能节省周期和费用,在全球经济下行的当下,可帮助医疗器械企业大幅降低成本!有研究表明,RWS相比RCT可节省时间约80%,费用约90%。
以下出海场景,建议优先考虑真实世界研究进行医疗器械临床评价:
1、首次CE认证
2、MDD换MDR证
3、PMCF
4、FDA认证
注1:目标医疗器械需已在国内获证,已有国内临床使用数据或即将在国内临床使用。一次研究,长久获益。首次打通医院数据,即可长期采集,实时更新数据,有利于长期做PMCF。
注2:除出海外,国内附条件上市后临床评价,也更适合采用真实世界研究,会有专门介绍,此文中不做重点讨论。
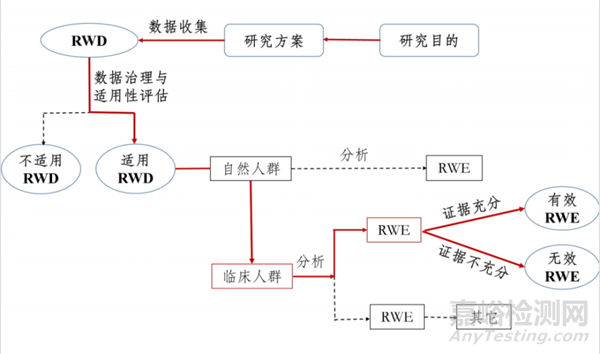
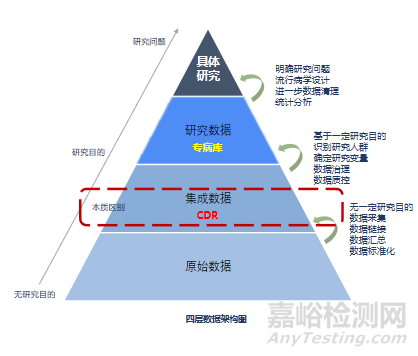
并非所有的临床数据都可以作为临床评价的证据。真实世界数据的产生源于对接医院系统获取到的原始数据,经过数据采集、数据链接、数据汇总、数据标准化,形成集成数据。集成数据基于一定研究目的识别研究人群、确定研究变量、数据治理、数据质控,形成研究数据即专病库。明确研究问题、流行病学设计、进一步数据清理、统计分析形成具体研究。过上述数据处理过程,真实世界数据才能形成真实世界证据。
同时医学术语集的建立也非常重要,术语集的建立经过专家组反复讨论、真实世界评估验证、修订形成终稿。持续迭代更新,确保数据元和数据集既符合临床实践,又符合国际标准,有利于医疗器械国内形成的临床证据受国际认可,便于用于海外上市认证!