前言
近几年我国医药产业的整体水平得到了显著提升,但国内儿童用药市场仍不成熟,存在较大的临床需求缺口。国家为此出台了一系列儿童用药相关的政策来鼓励企业开展儿童用药的开发,经历多年的完善,许多政策已见成效。
一、 我国儿童用药法规文件汇总梳理
对于快速上手儿童用药注册而言,我们只需掌握三个关键板块的法规:
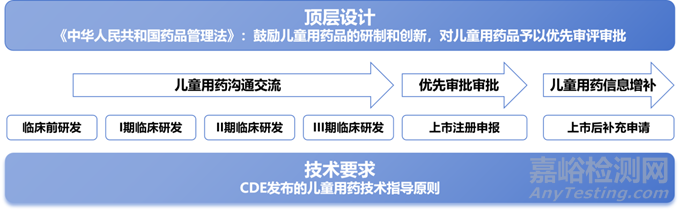
第一,即2019年新修订的《中华人民共和国药品管理法》,新修《药品管理法》将历年对儿童用药的鼓励性措施以法律的形式固定下来,明确对符合儿童生理特征的儿童用药品新品种、剂型和规格实行优先审评审批,奠定了国内儿童用药注册管理的核心制度,即儿童用药的优先审评审批,后续包括2020年新修的《药品注册管理办法》,《药品上市许可优先审评审批工作程序(试行)》以及2023年CDE发布的《药审中心加快创新药上市许可申请审评工作规范(试行)》均围绕此展开。
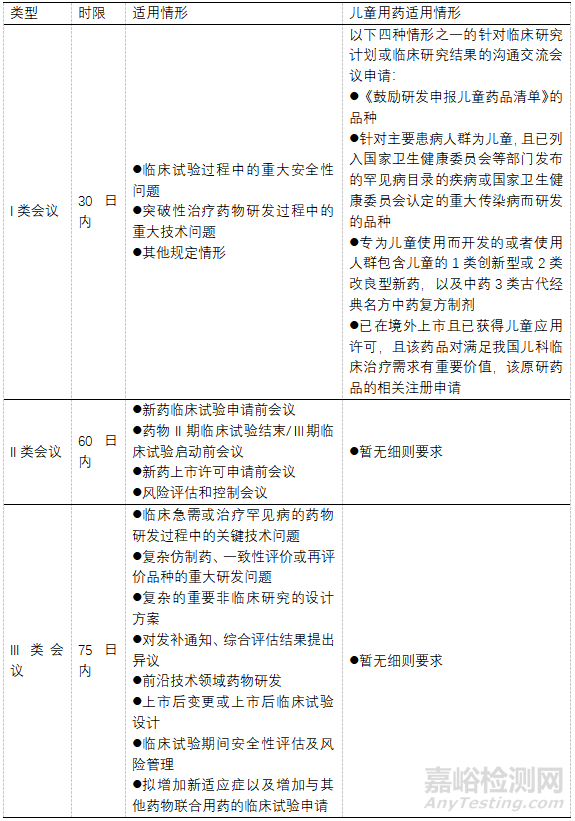
第二,CDE在2023年4月18日发布的《儿童用药沟通交流中Ⅰ类会议申请及管理工作细则(试行)》,该工作细则进一步细化了儿童用药沟通交流中I类会议申请及管理的相关要求,在我国药品沟通交流制度中单独开辟了儿童用药板块,对于儿童临床试验计划或儿童临床试验结果的沟通交流,申请人可直接发起I类会议申请,进一步缩短沟通所需时间,加快项目进度。
第三,则是NMPA在2023年5月31号发布的《已上市药品说明书增加儿童用药信息工作程序(试行)》,补上了儿童用药的注册周期的最后一块拼图,即对儿童用药的上市后管理。符合条件的儿科相关医疗机构、学会、行业协会可向CDE提出对已上市药品说明书增加儿童用药信息的书面建议,待通过审核并公示后,持有人可依据发布的信息,按程序提交已上市药品说明书增加儿童用药信息的相应补充申请。
即,我国儿童用药的注册管理体系基本可以分为三个板块:研发阶段的沟通交流、上市申报的优先审评审批和上市后的补充儿童用药信息,其中每一个过程都相互链接,且离不开CDE发布的相关儿童用药技术指导原则,整体结构如下图所示:
二、 儿童用药沟通交流会议
目前我国药品审评沟通交流制度的实施主要参照2020年CDE发布的《药物研发与技术审评沟通交流管理办法》,申请人与审评团队之间的沟通主要通过沟通交流会议进行,根据沟通交流的内容,沟通交流会议主要分为I类会议、II类会议和III类会议。而2023年4月发布的《儿童用药沟通交流中Ⅰ类会议申请及管理工作细则(试行)》在沟通交流制度的基础上进一步细化了儿童用药沟通交流中I类会议申请及管理的相关要求,对儿童用药适用I类沟通交流会议的情形作了更细致的要求。这份文件的征求意见稿和正式稿的差距还是挺大的,原《儿童用药沟通交流申请及管理工作程序(征求意见稿)》内容上有点绕,但核心程序基本可以概括为II类会议申请调整为I类会议进行管理,而正式稿则直接调整为在原I类会议的适用范围中的“其他情形”明确儿童用药的适用情形。儿童用药沟通交流会议工作时限及适用情形见表所示。
根据《工作细则》,儿童用药沟通会议的申请资料中还需附上《申请儿童用药沟通交流I类会议的说明》,当然近期有儿童用药沟通交流会议需求的同行还可以试着参照下CDE9月18日发布的关于公开征求《沟通交流申请资料要求》意见规范申请资料。
三、 儿童用药的临床试验申请
说到儿童用药,自然逃不掉对儿童用药临床试验的讨论,在笔者看来,对于儿童用1类创新药和2类改良型新药而言,CDE发布的《儿童用化学药品改良型新药临床试验技术指导原则(试行)》和《儿童抗肿瘤药物临床研发技术指导原则》里面已经做了较为清晰的划分和要求,争议较多的主要还是来自儿童用3类仿制药。我国于2016年开始制定发布《鼓励研发申报儿童药品清单》,其中有较多境外上市但境内未上市原研药品的药品,即3类仿制药。
目前CDE暂未针对儿童用3类仿制药的临床制定相关指导原则,此类儿童用药的临床申请可以参照CDE在2020年10月发布的《境外已上市境内未上市药品临床技术要求》,对于境内已上市药品增加境外已批准境内未批准的新剂型、新给药途径、新用法用量,用于境内已上市药品已批准适应证的情形,当已上市原研药品的临床试验数据显示,该药品用于中国患者的获益大于风险,且与境外人群数据相比药品安全有效且无种族敏感性的,可考虑豁免临床试验,仅需开展生物等效性(bioequivalency, BE)研究。而对于境内已上市药品增加境外已批准境内未批准的新适应证的情形,由于其涉及疾病和药物等多维度复杂因素,则较难评估。建议企业选择和CDE进行沟通交流。最后在临床试验申请中,还需要在注册申请表中备注申请儿童用药的信息,例如本品属于儿童专用药、申请新增儿童应用(适应症和用法用量)、本品属于鼓励研发申报儿童药品清单。(关于规范申请人儿童用药申报信息备注的通知)
四、 儿童用药的上市申请
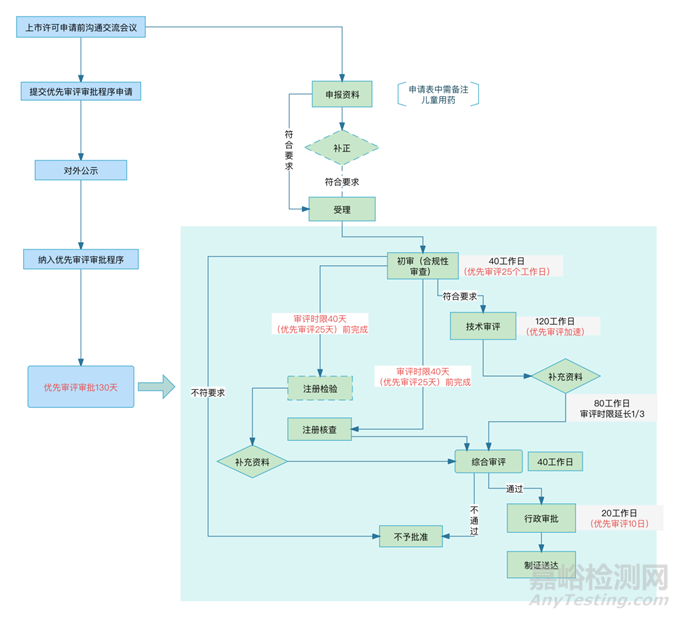
对于儿童用药,我们需要在提出药品上市许可申请前,申请II类沟通交流会议,探讨产品是否符合儿童用药优先审评审批程序纳入条件,以及现有临床研究数据是否满足药品上市许可审查要求等。若CDE初步评估认为产品符合优先审评审批纳入条件的,申请人需要在会议纪要中明确,并填写药品上市许可优先审评审批申请表,在CDE官方网站上的“优先审评审批系统”中进行申请。CDE在受理后在5日内对申请进行审核,并在CDE官方网站上对外公示拟纳入优先审评审批程序的产品,公示期为5日,若公示期间无异议,则纳入优先审评审批程序。对于纳入优先审评审批程序的药品上市许可申请,审评时限将从常规的200日变为130日。
除此之外,CDE还在2023年3月31日发布了《药审中心加快创新药上市许可申请审评工作规范(试行)》,不过该工作规范并非提出了一种新的上市程序,而是基于沟通交流制度和优先审评审批制度进行的整合,对于符合适用范围的儿童专用创新药进行早期介入,组建单独的专业审评团队负责儿童专用创新药从注册到审评审批的全过程管理,申请人可以就滚动提交资料相关事宜与CDE达成一致,也就是说可以在获得长期的疗效和安全性数据前提交上市申请,并在审评的过程中提交长期安全有效性数据,进一步缩短上市所需的时间,不过适用范围仅儿童专用创新药,在这之前还需要评估产品是否符合儿童专用创新药的情形。
五、 儿童用药的上市后管理
对于已上市药品的儿童用药信息增补,笔者认为可以分为两种路径。
对于已在国内获批上市的新药,如1类新药或者5.1类进口新药,企业可以根据CDE发布的《ICH E11(R1):用于儿科人群的医学产品的临床研究》《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》《成人用药数据外推至儿科人群的技术指导原则》,针对已上市药品开展儿童临床研究,并提交补充申请以完成儿童用药信息的补充。若申请境内外均未获批的新儿童适应症时,则可按照2.4类改良型新药提交申请。企业在儿童用药相关的补充申请时,同样需要备注相关事项,包括新增或修订儿童适应症或者用法用量、增加儿童专用规格、修订说明书中儿童应用信息或其他事项。
另一条路径则是根据NMPA在2023年5月31号发布的《已上市药品说明书增加儿童用药信息工作程序(试行)》,对于符合条件的原研药或者过评仿制药,国家儿童医学中心和民政部登记管理且具有儿童临床职能的医学药学专业学会(协会)可以提出补充说明书中儿童用药信息的建议。CDE在接收申请后,将对资料进行初审、品种遴选、提出修订建议、专家审议,在通过专家审议后对外公示30天,并由NMPA发布无异议的《品种名单和说明书修订建议表》。NMPA发布公告后,申请人可以根据公告信息,向CDE递交修订说明书的补充申请以增补说明书中的儿童用药信息。
六、 国外儿童用药注册路径
最后,在这个国产创新药开始出海的时代,我们还需要额外关注欧美的儿童监管要求。因为和国内不同,欧美的法律要求所有上市新药均需要完成儿童临床研究,除非满足豁免或者延期的条件,例如证明这个药物的适应症在儿童人群中发病率极低之类的。