您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-07 08:55
设计转换,顾名思义,或通俗的理解,是将设计(研发端)转向制造(运营端),但需要理解的是,并不是说运营端(某些时候部分同行可能会理解成仅仅是生产部)可以按SOP生产就算是完事了。另外,在与同行间接或直接交流设计转换的话题时,常常提及到的还有转换的时机,在什么阶段进行。
法规的要求,在NMPA和FDA市场监管下,提及设计转换要求的有:
1)GB/T 42061 idt ISO 13485的7.3.8;
组织应将设计和开发输出向制造转换的程序形成文件。这些程序应确保设计和开发输出在成为最终生产规范前经验证适合于制造并确保生产能力能满足产品要求。
2)YY/T 0595应用指南里对7.3.8条款的解释;
3)21CFR 820.30(h)
4)DESIGN CONTROL GUIDANCE FOR MEDICAL DEVICE MANUFACTURERS 的 H章节,(也可以理解成对21CFR 820.30(h)条款的解释);
除了法规标准的要求外,也还有一些相关的书籍有提到,如Marie B. Teixeira 团队编写的DESIGN CONTROL FOR THE MEDICAL DEVICE INDUSTRY。
过程 process
利用输入实现预期结果的相互关联或相互作用的一组活动
活动 activity
<项目管理>在项目中识别出的最小的工作项

过程三要素图
乌龟图,个人的理解是在上述过程图中进一步完善细化后而形成,形似乌龟而称为乌龟图(四肢+首尾+主体),如下图所示。
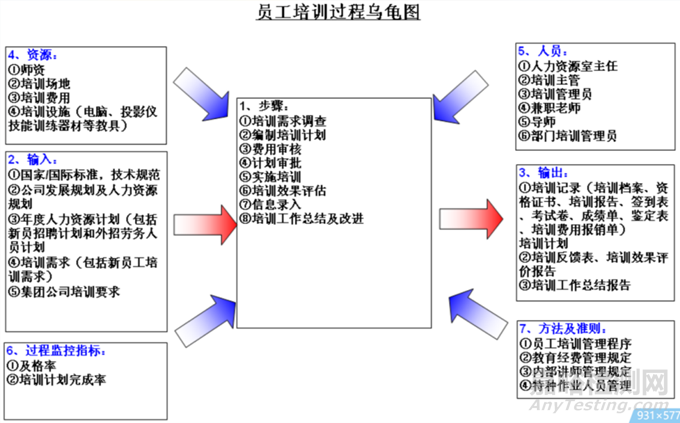
乌龟图示例
对于设计转换活动来说:
乌龟的BODY
第1步,确定我们的过程名称是什么,是设计转换。
第2步,确定我们的活动范围是什么,是具体的某个项目要开始启动设计转换了,最终工作是完成设计转换的评审,输出设计转换报告。
乌龟的HEAD
第3步,确定输出是什么,什么是设计转换的输出,要输出哪些东西,上边提到最终工作是完成设计转换的评审,评审内容是设计转换的报告。设计转换报告应包含哪些内容呢,可以往后看。
第4步,确定有哪些客户,设计转换的客户一般是内部客户,主要是供应链,包括:生产部、采购部、工程部、质量部、PMC;供应链团队的要求是什么呢,继续往后看。
第5步,确定客户的要求是什么,假想你是供应链成员,你对设计转换的结果会提哪些要求,最直接的莫过于我们生产员工能够独立生产制造出来。但仅仅是制造出来是不够的,高质量、高效率,是大家都追求的。
对于生产部来说,是否是最终的操作SOP,员工是否都理解了每个生产步骤;-最终的生产SOP,包括生产流转卡。
对于采购部来说,是否是最终的原材料技术要求,能不能买到符合项目要求的材料,供应商是否会存在原材料技术要求的偏差理解; 除了原材料,生产检验过程中工装图纸是否是完整最终的; -最终的原材料或辅料的技术标准,生产检验工装的图纸及技术要求。
对于工程部来说,研发过程中的生产/检验设备/工装模具是否是OK的,是否是经验证或确认的,生产过程中的失效模式是否已分析并得到解决;总不能完成设计转换后的生产还出现这个设备故障那个设备缺失吧。-经验收的生产/检验设备/工装模具单/清单。
对于质量部来说,来料、制程、终检是否是确定的,并经运行表明没有理解偏差的,检验的结果是否是接受认可的,合格率是否达到预期目标;-最终的检验SOP,试生产的数据统计/合格率。
对于PMC来说,能不能按计划来进行生产,原材料供应是否是满足生产要求的;-BOM是否经审核并受控。
乌龟的TAIL
第6步,确定输入是什么,做这个设计转换活动的前提是什么。
完成产品定型后,不是输出了DMR文件嘛,BOM表,生产/检验SOP,产品/工装/夹具的图纸,原材料的质量标准等;-法
人员,是否有足够的人力资源可参与设计转换;-人
物料,是否有足够的物料供试生产; -料
设备,是否有可使用的设备供试生产;-机
设施/场地,是否有可满足生产的场地/场所;-环
第7步,确定输入的供应者是谁。
多数文件一般是由研发输出,人员由生产部门提供,物料由采购部门采买,设备/设施由组织提供,缺少的由项目由向组织申请采购,不过一般都是在开发阶段就已经购买的。
第8步,输入的要求是什么,仅仅是有就够了吗?
文件要有质量,是指写的清晰,一看即懂;人员需经培训合格后上岗;物料需按体系要求进行出入库; 设施/场地是否有洁净要求,还是普通车间即可。
乌龟的LIMBS
第9步,做这个设计转换时,是否有什么工作标准,它的制订者是谁,是否有什么要求?
这里是指公司管理层确定的,不能改变的,一般是质量方针,质量手册里的内容。
第10步,做这个设计转换时,是否需要什么设施/设备,提供者是谁,要求是什么?
和上面提到的略有相同,不过这里一般指的是固定设施/场所,洁净度/温/湿度等要求。
第11步,做这个设计转换时,是否需要什么培训,谁来培训,培训有什么要求?
是指满足客户的要求,为了达到客户的要求,需要做什么。
一般是指SOP的编制者对SPO的执行者进行的培训。
第12步,做这个设计转换时,是否有什么程序或者规定,谁制定的,有什么要求?
也是指满足客户的要求,一般含在质量管理体系中,如要做这个设计转换,公司层面是否有相关的程序或制度规定这个活动应该怎么做,要做哪些事项等。
以上内容是个人首次运用乌龟图进行设计转换活动的分享,使用不对或不正确的地方,恳请指正。
总结:
设计转换活动,结合PMP项目管理五大过程组:
1)启动时,召集相关的同事(研发、供应链团队)开设计转换的启动会,目的是告诉供应商团队,我们研发已做好启动设计转换活动的准备了。
比如说,告诉供应链团队,我们的DMR文件都已经受控了,设计验证做完了,过程确认也通过了,物料、工艺是有保障的。
2)做好设计转换活动的规划,如设计转换计划表,包含要做的内容,预计多久/在什么时候做完,对应的责任人是谁等。编制好后,就可以找相关的负责人确认签字了。(当然这个最好在启动会上先拿出初稿过一遍,会后挨个找确认并签字)
3)接下来说是实施了,人员确认,人员培训,文件(BOM表,图纸等)确认/转交;根据需要进行产品的试生产了;
4)接着就是监控阶段了,试生产的数据分析情况怎样,PFMEA的验证怎样了,风险是否已经降低或提高,是否需要更新PFMEA。
5)最后就是收尾了,拿出数据,如试生产的质量数据,培训的凭证,文件/更新的受控凭证等,再次召集相关的同事共同完成设计转换活动的评审,若达到预期目标则通过设计转换。结果一般会是通过的,不然一般不会召集评审,说的直白一点,明知可能通不过,召集开会干啥呢。
最后,再简单说一下转换的时机,(建议可以直接看前面提到的《浅谈医疗器械设计开发转换》,但稍不些不同观点)
瀑布流模型中未提到设计转换的概念,但结合什么是设计转换,回到开头,“是将设计(研发端)转向制造(运营端)”。转换应分2类,一类是新产品的研发,另一类是改进型产品的研发设计转换。
改进型产品的设计转换可以较早期就开始,因此是改进型的研发,人机料法环各方面是已经相对成熟的了。
新产品的设计转换,应在完成设计验证,过程确认活动中就可以启动。因为完成设计验证,说明设计输出满足设计输入,产品已经定型,DMR文件已经形成,并已进行了产品的试制(此时可能是研发带着生产一起做验证的样品),为什么是在确认中就可以启动进行呢?
确认分生产和设计的确认,生产的确认即过程确认,设计的确认即设计确认(临床试验),完成过程确认的OQ阶段就可以启动转换活动了,因为OQ已经通过,说明工艺是OK的;临床试验中进行是因为,临床产品本身就是由生产人员进行生产,最多是研发现场跟进,已经入组了部分,或30%,或40%样子,如果正常临床试验,基本可以说明产品达到预期用途,即得到初步确认。
既已验证,已初步确认,产品已定型,基本不会再改动了,此时正是设计转换的时机,小批量试生产,一批或多批次,生产的过程的数据还可以拿来作为设计转换通过的支持凭证。

来源:医械研发


