您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-11 10:52
医用气体报警系统包括医用压缩气体供应系统、医用气体汇流排及真空供应系统等,包含气体监测、报警功能的产品。
根据《医疗器械分类目录》,分类编码为08-07-06,管理类别为Ⅱ类。
一、医用气体报警系统的结构组成与工作原理
1、结构组成
医用气体报警系统通常由传感器、显示面板、控制电路和集中监测与报警管理系统(医用气体报警器不包含该组件)组成,是医用供气系统的监测部分。
产品结构示例如图1:
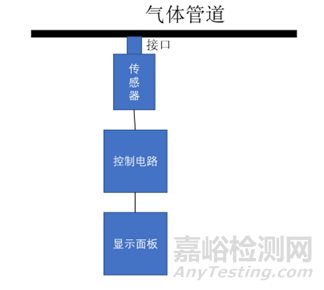
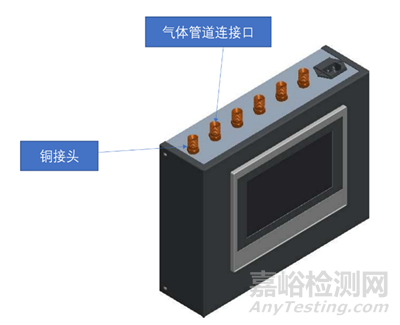
图1 医用气体报警器结构示意框图
产品结构示例如图2:
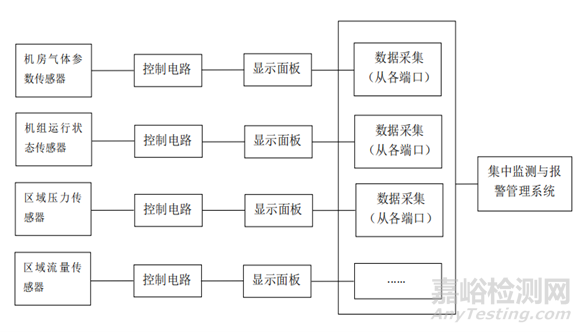
图2 医用气体报警系统结构示意框图
注:上述结构示意图仅供参考,具体产品结构组成应根据实际情况确定。
2、产品工作原理
将传感器采集到的信号经计算、处理并传输至显示面板和/或集中监测和报警平台,实现气体参数的显示、监测、报警和数据管理等功能。需同时明确传感器工作原理。
二、医用气体报警系统的主要风险
医用气体报警系统的常见危害见表
表 医用气体报警系统的常见危害
|
主要风险点 |
可能产生的危害 |
|---|---|
|
电磁兼容 风险 |
在强电磁辐射源边使用设备,受电磁辐射干扰,导致监测数据出现非正常变化。 |
|
电磁干扰周围设备,导致周围设备异常或无法使用。 |
|
|
能量风险 |
静电导致产品损坏。 |
|
可触及部分与带电部分隔离/保护不够,对使用者造成电击伤害。 |
|
|
机械风险 |
外壳破损或内部组件损坏,产品无法维持基本安全或性能。 |
|
产品外壳机械强度和刚度不足,产品面、角、边粗糙等对使用者造成危害。 |
|
|
坠落导致元器件损坏等;正常的外部机械力造成设备故障或损坏。 |
|
|
长时间及过高的供气压力,导致传感器损坏。 |
|
|
性能风险
|
关键部件故障,传感器断线,无法检测到相应参数。 |
|
报警故障,潜在故障时未报警。 |
|
|
电气部件的运行故障导致供电中断。 |
|
|
报警系统断电恢复无自启动功能。 |
|
|
系统超过使用寿命后可能导致运行缺陷,数据不准确,部分功能缺失等。 |
|
|
温度、湿度、电压等超出正常工作条件,对设备的可靠性、稳定性和安全性产生影响。 |
|
|
生物学风险 |
气路材料的生物相容性风险。 |
|
与输送给患者的气体接触的材料释放出有毒、有害物质的风险。 |
|
|
软件风险 |
软件异常,导致系统无法正常运行,不能实现气体参数的监测、报警功能。 |
|
维护风险 |
产品未正常维护,传感器未经校准或者损坏,导致监测参数不准确。 |
|
操作错误 |
未经培训的人员使用设备,错误操作导致设备损坏。 |
|
未在使用前进行功能测试,出现系统不能正常运行,不能实现气体参数的监测、报警功能。 |
|
|
因使用者视力等原因无法准确识别显示屏上所示监测参数。 |
|
|
不完整的 说明书 |
操作说明中缺少必要的警告、使用方法、技术参数等,可能出现操作错误,不能正常使用该系统。 |
|
不正确的消毒方法,使用有腐蚀性的清洁剂、消毒剂,导致产品部件腐蚀,防护性能降低。 |
|
|
不正确的产品贮存条件,可能出现器件老化,部件寿命降低,导致产品性能降低。 |
|
|
制造风险 |
不同材质的元器件相互替代时未作必要的兼容性测试、或未进行性能验证及相应的风险分析。 |
|
供方评审、进货检验等不充分;未对关键部件及影响产品安全有效性部件的供应商进行有效管理。 |
三、医用气体报警系统性能研究实验要求
1、产品性能研究
应当开展产品性能研究以及产品技术要求的研究,明确包括功能性、安全性指标(如电气安全与电磁兼容)以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
YY/T 0186是推荐性标准,适用于医用中心吸引系统产品。对于真空负压系统的压力监测需符合4.2.4要求。
YY/T 0187是推荐性标准,适用于医用中心供氧系统产品。对于供氧系统的压力监测需符合4.4要求。
GB 50751是强制性国家标准,适用于医疗机构对医用气体工程(包含医用气体报警系统)设计、施工和验收。对于GB 50751中的强制性条款,必须严格执行。经评估,医用气体报警系统没有适用的强制性条款。
ISO7396-1:2016中关于监控和报警系统采纳IEC 60601-1-8,故电气安全建议采纳GB 9706.1。部分企业如已采纳GB 4793.1和GB/T 18268.1,延续时可直接沿用GB 4793.1和GB/T 18268.1,但首次注册建议执行GB 9706.1。如ISO 7396-1转换成国内标准,按最新标准规定执行。
ISO 7396-1:2016对于临床紧急报警(管道压力超出额定压力±20%)的监测和报警信号,需要符合IEC 60601-1-8要求。建议区域报警(根据GB 50751,报警分为区域报警和气源报警)执行IEC 60601-1-8的转换标准暨YY 9706.108。区域报警器,比如护士站、病房区域氧气压力监测的报警器,应符合YY 9706.108要求;而对于气源报警,只要求按GB 50751和YY/T 0187(仅适用于医用中心供氧系统)具有相应的报警功能;负压报警,按GB 50751和YY/T 0186具有相应的报警功能。
2、燃爆风险
对于暴露于易燃、易爆气体的组件(如传感器),应当开展燃爆风险研究,证明在正常状态及单一故障状态下,燃爆风险可接受。与氧气接触的部件,应符合YY/T 0882要求。
3、生物学特性研究
评价与患者直接或间接接触部分的生物相容性,如传感器。建议参照YY/T 1778.1对呼吸气体通路进行生物学研究。鼓励有条件的企业根据ISO 18562系列标准评价气体通路生物相容性。
研究应当明确生物相容性评价的依据和方法,产品所用材料及与人体接触的性质、材料应用历史,实施或豁免生物学试验的理由,对于现有数据、安全使用历史或试验结果的评价。
4、灭菌/消毒工艺研究
终端用户消毒:如适用,应明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。
5、软件研究
应参照《医疗器械软件注册审查指导原则(2022年修订版)》相关要求开展软件研究。
若适用,还应当按照《医疗器械网络安全注册查指导原则(2022年修订版)》要求开展网络安全研究。
6、联合使用
如申报产品预期与其他医疗器械、非医疗器械产品联合使用实现同一预期用途,应当开展证明联合使用安全有效的研究,包括互联基本信息(连接类型、接口、协议、最低性能)、联合使用风险及控制措施、联合使用上的限制、兼容性研究等。
7、环境试验
开发人应按照GB/T 14710的要求开展相关研究。检测项目选取原则为与电气部分相关的性能指标(如报警装置对应的相关性能指标)。
8、稳定性研究
8.1使用稳定性
参见《有源医疗器械使用期限注册技术审查指导原则》相关要求,应当开展使用稳定性/可靠性研究,证明在生产企业规定的使用期限/使用次数内,在正常使用、维护情况下,产品的性能、功能满足使用要求。
8.2运输稳定性
应当开展运输稳定性和包装研究,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。

来源:嘉峪检测网


