您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-06-27 10:15
针对过量灌装,审评老师大体会问(1)过量灌装的合理性,(2)过量灌装的量制定的合理性,(3)并结合临床用法及本品和参比制剂复溶后抽取情况予以说明。针对过量投料,审评老师大体会问是否考虑了产品的安全性与有效性,(1)超过的量,(2)过量投料的理由(即补偿预期的并被证明了的生产中的损失),(3)超过的量的理由。
审评老师不同的问法体现出了过量灌装和过量投料的本质区别,过量灌装的目的在于使化学仿制药注射剂的过量灌装宜与参比制剂保持一致,确保每支(瓶)产品的给药剂量均不低于标示量。过量投料的目的在于补偿预期的并被证明了的生产中的损失,但一般不提倡在药品生产中过量加入原料药,以补偿药品在生产或其有效期内的降解,或试图延长产品的货架寿命期。
本文依据(1)《中国药典》(2020年版四部0102注射剂)、(2)2020年5月CDE发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中关于过量灌装的阐述“如参比制剂存在过量灌装,仿制药的过量灌装宜与参比制剂保持一致,如不一致需提供合理性论证。”、(3)2023年9月CDE发布的《化学仿制药注射剂过量灌装研究技术指导原则(征求意见稿)》、(4)ICH药品研发Q8(R2)中针对过量投料的说明以及本人在工作中的实践经验并结合实例对化学仿制药注射剂过量灌装、过量投料进行较为系统的思考,不当之处还请业内同行予以探讨补充。
1、过量灌装
(1)何为过量灌装?
何为过量灌装?《化学仿制药注射剂过量灌装研究技术指导原则(征求意见稿)》给出了详细的阐述:“注射剂的过量灌装是指每个容器中药品的灌装量较标示量适当增加的体积或重量,以确保实际给药剂量满足说明书中规定的用量。”
(2)影响过量灌装的因素
在临床使用过程中需将注射剂转移出来输注至患者体内,实际给药剂量不可避免的受到药液粘度、包材黏附及输注系统黏附的影响,从而需要较标示量适当增加合适的体积或重量,以确保实际给药剂量满足说明书中规定的用量。
(3)过量灌装的目的
确保实际给药剂量达到说明书中规定的用量。
(4)过量灌装制定的依据
①《中国药典》(2020年版四部0102注射剂)注射剂的灌装标示装量不大于50ml时,可参考中国药典推荐的易流动液和粘稠液过量灌装量,适当增加装量。
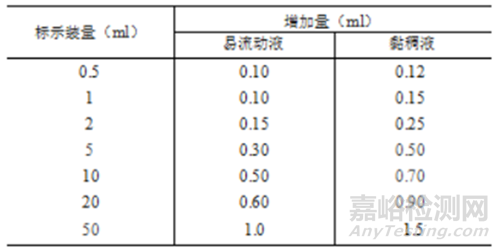
②注射液应照《中国药典》(2020年版四部0102注射剂)项下装量方法进行检查,每支(瓶)的装量均不得少于其标示装量。
③冻干粉针应照说明书中规定的使用方法进行抽提试验并测定复溶后溶液浓度,保证自制制剂实际可抽取剂量与参比制剂保持一致且不低于标示量。
④《化学药品注射剂仿制药质量和疗效一致性评价技术要求》:为确保仿制药用法用量与参比制剂的一致性,化学仿制药注射剂的过量灌装宜与参比制剂保持一致,如不一致需提供合理性论证,应确保每支(瓶)产品的给药剂量均不低于标示量。
综上所述,化学仿制药注射剂的过量灌装宜与参比制剂保持一致,确保每支(瓶)产品的给药剂量均不低于标示量,并符合《中国药典》(2020年版四部0102注射剂)中关于增加装量及装量检测的要求。
(5)过量灌装不科学合理的危害
增加的灌装量使可转移剂量低于标示量:导致患者用药不足,疗效降低。
增加的灌装量使可转移剂量高于标示量:可能会由于明显的药物过量而引起安全性方面的风险,以及给药后药瓶中残留药品过多可能误用于第二剂而造成的药品污染、错用等风险。
2、过量投料
(1)何为过量投料?
在药品生产过程中,投料量超过处方量的100%以上,为过量投料。过量投料多数情况下指的是原料药过量投料。
(2)影响过量投料的因素
在药品生产过程中,原辅料经过多个生产步骤,如搅拌、过滤、高温灭菌等,由于原辅料理化性质或生产工艺的因素,一些制剂会出现化学降解或物理吸附等现象,
(3)过量投料的目的
确保最终制剂符合质量要求。
(4)过量投料制定的依据
ICH药品研发Q8(R2)中针对过量投料明确指出:
一般不提倡在药品生产中过量加入原料药,以补偿药品在生产或其有效期内的降解,或试图延长产品的货架寿命期。
任何在制剂生产中的过量投料,不管是否出现在最终的制剂成品中,都需证明是否考虑了产品的安全性与有效性。该证明包括以下信息:
1)超过的量;
2)过量投料的理由(即补偿预期的并被证明了的生产中的损失);
3)超过的量的理由。
(5)过量投料不科学合理的危害
增加的过量投料不足以补偿预期的并被证明了的生产中或使用中的损失,使可转移至患者的剂量低于标示量,导致患者用药不足,疗效降低。
增加的过量投料多于预期的并被证明了的生产中或使用中的损失,使可转移至患者的剂量高于标示量,导致患者用药过量而引起安全性方面的风险。
3、过量灌装实例解析
以参比制剂为注射液(10ml:50mg)为例:
(1)参比制剂分析
以参比制剂规格为10ml:50mg为例,依据《中国药典》(2020年版四部0102注射剂)项下装量方法对参比制剂的装量进行研究,检测方法如下所示。

检测方法:
①药液浓度
依据拟定的含量检测方法检测含量;
②可抽取体积
注射液及注射用浓溶液按照《中国药典》(2020年版四部0102注射剂)项下装量方法进行检查,即为可抽取体积,操作如下:
供试品标示装量不大于2ml者,取供试品5支(瓶);2ml以上至50ml者,取供试品3支(瓶)。开启时注意避免损失,将内容物分别用相应体积的干燥注射器及注射针头抽尽,然后缓慢连续地注入经标化的量入式量筒内(量筒的大小应使待测体积至少占其额定体积的40%,不排尽针头中的液体),在室温下检视。每支(瓶)的装量均不得少于其标示装量。
③绝对体积
采用重量除以相对密度计算装量,即为绝对体积,操作如下:
取供试品5个(50ml以上者3个),除去外盖和标签,容器外壁用适宜的方法清洁并干燥,分别精密称定重量,除去内容物,容器用适宜的溶剂洗净并干燥,再分别精密称定空容器的重量,求出每个容器内容物的重量与平均重量,采用平均重量除以相对密度计算出绝对体积。
(2)仿制药灌装量的制定
①理论灌装量上下限
理论灌装量下限=标示装量+过量体积(ml)
理论灌装量上限=标示装量×合理论证的系数+过量体积(ml)
过量体积:根据《中国药典》(2020年版四部0102注射剂)建议的过量灌装体积为0.5ml。
合理论证系数:合理论证系数考虑含量范围的话,含量范围是95%-105%,则合理论证系数上限为1.05。
理论灌装量下限=10ml(标示装量)+0.50ml(过量体积)=10.50ml
理论灌装量上限=10ml(标示装量)×1.05(合理论证系数)+0.50ml(过量体积)=11.00ml
②内控灌装量上下限
合理论证系数:合理论证系数考虑灌装精度的话,灌装精度为±1%,合理论证系数的中间值为1.01,下限1.00,上限1.02,合理论证系数取上限1.02。在实际生产中根据灌装精度控制灌装量上限更具有科学性及实用性,即选择灌装精度上限作为合理论证系数。
内控灌装量下限=10ml(标示装量)+0.50ml(过量体积)=10.50ml
内控灌装量上限=10ml(标示装量)×1.02(合理论证系数)+0.50ml(过量体积)=10.70ml
目标灌装量=10ml(标示装量)×1.01(论证系数中间值)+0.50ml(过量体积)=10.60ml
③自制制剂装量分析
依据内控灌装量上下限制备自制制剂,并对自制制剂的装量进行研究。

(3)小结
该品种灌装量可以设定为理论灌装量范围:10.50ml~11.00ml,内控灌装量范围:10.50ml~10.70ml,目标灌装量:10.60ml。自制制剂过量灌装与参比制剂一致,且确保了每支(瓶)产品的给药剂量均不低于标示量。
4、过量投料实例解析
以具有缓控释功能的激光打孔渗透泵片剂为例:
由于此类制剂本身的固有缺陷以及活性物质的理化性质会导致①部分药物不能完全被泵出,②药物存在反渗透现象而使少部分药物储留于片壳内,为了保证药品的有效性,所以需要通过过量投料以补偿这部分的药物损失。例如:
(1)辉瑞生产的格列吡嗪缓释片过量投料 10%;
(2)辉瑞生产的甲磺酸多沙唑嗪控释片过量投料5%;
(3)拜耳生产的硝苯地平控释片过量投料10%;
5、过量灌装、过量投料,如何科学合理的选择?
过量灌装的目的在于使化学仿制药注射剂的过量灌装宜与参比制剂保持一致,确保每支(瓶)产品的给药剂量均不低于标示量,并符合《中国药典》(2020年版四部0102注射剂)中关于增加装量及装量检测的要求。
过量投料的目的在于补偿预期的并被证明了的生产中的损失,但一般不提倡在药品生产中过量加入原料药,以补偿药品在生产或其有效期内的降解,或试图延长产品的货架寿命期。
根据对过量投料相关指导原则(ICH药品研发Q8(R2))的分析及对药品安全性、有效性的理解,对于生产过程中的过量投料应当非常慎重,应当通过优化制剂处方、生产设备、生产工艺等方法避免过量投料。
(1)优化制剂处方
①优化原料药晶型结构;
②优化辅料种类及型号;
③提高原辅料相容性;
(2)优化生产设备
①避免盲管导致的死体积;
②通过压缩空气吹扫,减少管道水分残留;
③避免金属离子对活性物质的催化降解及离子交换;
④筛选过滤器型号,以降低过滤器对活性物质的吸附;
(3)优化生产工艺
①优化药液配制温度,避免药物因高温而降解;
②优化生产过程中使用的光源,避免药物因光敏感而降解;
③优化药液pH,保证药液处于最稳态;
对于生产过程中确实需要过量投料的,过量投料不管是否出现在最终的制剂成品中,都需证明是否考虑了产品的安全性与有效性。需要提供详细的支持性资料,说明过量投料的必要性和合理性,如果活性物质出现了降解,需要提供活性物质的降解途径及降解产物的安全性资料,同时还应提供过量投料与含量降低的匹配性、含量降低与杂质增加的匹配性等相关资料。
即,该证明包括以下信息:
1)超过的量;
2)过量投料的理由(即补偿预期的并被证明了的生产中的损失);
3)超过的量的理由。
6、总结
本文通过对过量灌装、过量投料进行较为系统的思考,重点考虑产品的安全性与有效性,并结合工作中的实际案例,科学、合理的选择过量灌装或过量投料,希望可以给到同行一些参考。
随着《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学仿制药注射剂过量灌装研究技术指导原则(征求意见稿)》、ICH药品研发Q8(R2)的不断完善,关于化学仿制药注射剂过量灌装、过量投料的研究方法和研究策略逐渐增多,科学、合理的制定化学仿制药注射剂过量灌装、过量投料,在满足说明书中规定用量的同时减少使用过程中的安全性风险正在变得可实现。
7、参考文献
1. 国家食品药品监督管理总局《化学药品注射剂仿制药质量和疗效一致性评价技术要求》(2020 年 5 月).
2. 国家食品药品监督管理总局《化学仿制药注射剂过量灌装研究技术指导原则(征求意见稿)》(2023 年9 月).
3. 《中国药典》(2020年版四部0102注射剂)
4. ICH药品研发Q8(R2)
5. FDA. Allowable Excess Volume/Content in Injectable 104 Drug and Biological Products(MAPP 5019.1 Rev 1).2022
6. USP<1151> Pharmaceutical dosage forms
7. USP< 697> Container content for injections

来源:药事纵横


