您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-07-17 10:26
1.UDI到底是什么?功能是什么?
根据MDR Article 2(15)的定义:
“医疗器械唯一标识”(UDI)是指通过国际认可的器械标识和编码标准创建的一系列数字或字母数字字符,并可以明确识别市场上的特定器械;
“Unique Device ldentifier’('UDI’) means a series of numeric or alphanumeric characters that iscreated through internationally accepted device identification and coding standards and that allowsunambiguous identification of specific devices on the market.
对应的,UDI也有MDCG指南,在MDCG 2021-19关于在组织质量管理体系中整合UDI的指导说明中,也介绍做了解释:“医疗器械唯一标识(UDI)系统应有助于识别医疗器械,促进医疗器械的适当可追溯性,提高医疗器械上市后安全性相关活动的有效性,改善事件报告,增强现场安全性纠正措施的针对性,从而更好地监督,减少医疗错误,帮助打击伪造器械。因此,UDI系统预期包含在器械的生命周期中。”
2.为什么要了解欧盟MDR法规下的UDI要求?
2.1 法规依据
因为所有在欧盟售卖的医疗器械,除了定制器械,都要使用UDI,MDR (42)写道:
UDI系统宜适用于除定制器械以外的投放于市场的所有器械,并基于国际公认的原则,包括与主要贸易伙伴相一致的定义。为使UDI系统及时起作用,以免影响本法规生效,宜在本法规中做出详细规定。
The UDI system should apply to all devices placed on the market except custom-madedevices, and be based on internationally recognised principles including definitions that arecompatible with those used by major trade partners. In order for the UDI system to becomefunctional in time for the application of this Regulation, detailed rules should be laid downin this Regulation.
在MDR Article 10制造商的义务中,第7点写道:“制造商应遵守第 27 条中所述的 UDI系统相关义务,以及第 29 和 31 条所述的注册义务。Manufacturers shall comply with the obligations relating to the UDl system referred to inArticle 27 and with the registration obligations referred to in Articles 29 and 31.”
2.2 谁需要履行UDI的义务?
2.2.1 一般义务
除制造商 (Manufacturer)/经销商(Distributors)/进口商(Importers)或其他自然人、法人,若满足MDR Article 16 制造商的义务适用于进口商、经销商或其他人的情况的第1点,也有义务器械需满足UDI规定:
经销商、进口商或其他自然人或法人若做出以下任何行为,则应承担制造商相应义务:
(a) 在市场上提供以其名字(Name)、注册商标名称(Registered trade name)或注册商标 (Registered trade mark) 命名的器械,除非经销商或进口商与标签上标明的制造商签订协议,其中规定由制造商承担本法规对制造商规定的要求;
(b) 变更已投放市场或投入使用的器械的预期用途( Intended purpose);
(c) 更改已投放市场或投入使用的器械,且对符合性产生影响。第一子段不适用于为个别患者组装或改装已上市器械(且未更改器械之预期用途)的任何人员(此等人员并不视为Article 2第(30)点所定义之制造商)。
也就是说,根据MDCG 2018-6 <与MDR Article 16和IVDR相关的UDI相关责任声明>,若有上述行为,则经销商(Distributors)/进口商(Importers)或其他自然人、法人须注册为制造商 (Manufacturer)、拿到SRN (Single Registration Number)、申请符合性评估,并为产品注册(feed and provide UDI-product registration)。
另外,经销商 (Distributors)、进口商 (Importers) 或其它自然人、法人若:
-翻译制造商提供给客户的文件 (使用说明书),或
-在不影响产品原始状态下,为了于相关成员国上市,而不得不变更外包装 (灭菌产品例外) 时
须注意
-不可影响 UDI carrier (识别码载体) 的可读性,且
-须有相关质量管理体系去:
(1) 确保信息译文正确准确更新及时
(2) 保证变更包装不影响产品原有状态
(3) 至少于将上述产品 (重贴标、重包装等) 贩卖到市场前 28 天,通知并提供样品 (包含相关说明书) 给制造商与 Competent authority (主管当局,CA)。
2.2.2 系统和手术包的UDI要求
除了上述的制造商( Manufacturer)、经销商(Distributors)、进口商(Importers) 外,还有符合下列 Article 22 第4点规定的也要遵守 UDI 的要求:
1) 若系统或手术包包含不带 CE 标识的器械
2) 或所选择的器械组合由于其原始预期用途而不兼容,
3) 或未根据制造商的说明进行灭菌,则系统或手术包应视为独立的器械,并应依照Article 52进行相关的符合性评估流程。此外,自然人或法人应承担制造商的义务。
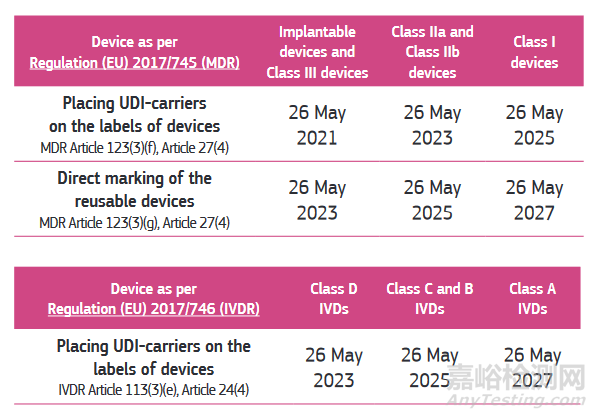
2.3 UDI timeline
UDI 分配义务:自MDR和IVDR新法规实施之日起适用。
在 EUDAMED 数据库中提交 UDI 数据的义务:该义务在 EUDAMED 全面运作 24 个月后生效。
根据指南MDCG 2021-19,放置 UDI载体的义务按照以下时间表执行:
3. UDI由谁核发?
在MDR Article 27 第2点要求,委员会应通过实施细则指定一个或多个实体来根据本法规规定操作一个 UDI分配系统(委任实体)。实体应满足第2点的5项要求。
因此,欧委会在 2019年发布 Commission Implementing Decision (EU) 2019/939,在此指定下列机构:
(a) GS1 AISBL (中国制造商较多选择,其在中国也有分公司,FDA的UDI也是认可GS1的)
(b) Health Industry Business Communications Council (HIBCC)
(c) ICCBBA
(d) Informationsstelle für Arzneispezialitäten — IFA GmbH

4. UDI的编码规格
UDI由两串文字/数字组成,一个是UDI-DI,一个是UDI-PI。
根据IMDRF/UDI WG/N48FINAL:2019-UDI System Application Guide-Sec. 6.1 “The UDI is composed of two parts: Device Identifier (UDI-DI) + Production Identifier (UDI-PI) = Unique Device Identifier (UDI). UDI-DI + UDI-PI = UDI.”
4.1 UDI-DI
相较于UDI-PI,UDI-DI是固定不变的(没有任何设计变更时),用来代表制造商内特定的产品和包装配置。
若选择国内常见的GS1就是UDI-DI,若选择其他发证机构,则UDI-DI会是其他编码原则与名称。例如HIBC-UPN (Universal Product Number) 或 ICCBBA ISBT 128-PPIC (Processor Product Identification Code)。
4.2 UDI-PI
相较于UDI-DI ,PI是动态的,用来辨别产品制造商信息,可以有很多种形式,例如Lot/Batch 、Serial Number、Expiration Date、Date of manufacture 、Version 、Distinct Identification Code (DIC,Medical products of human origin (MPHO) 特有)。
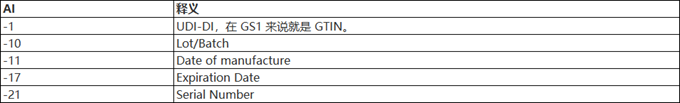
4.3 Application Identifiers (AI)
在 GS1 的 UDI-DI 和 DUI-PI 前会有括号,括号内有两个数字,称为Application Identifiers/AI,可由 AI 了解某串数字是 UDI-DI,或是 UDI-PI 的制造日期、有效期、批号、序列号等
以下为GS1的常见AI
4.3 UDI carrier (UDI载体)
可分为两大类,一为UDI Human Readable Interpretation (HRI,人眼可识别文字信息,另一类为Automatic Identification Data Capture (AIDC,自动识别技术。前者,由文字/数字组成;后者可能是一维码/二维码等。
例如下图GS1官网的实例,此为GS1 Data Matrix形式。

上面的二维码是 AIDC;下方数字是 HRI,上下两串数字分別代表UDI-DI和有效期。医疗器械的UDI载体除了可选择GS1 Data Matrix,还可以选择GS1-128。
5. UDI 放在哪?
MDR 规定,UDI 要放在标签与各层包装上,但不放在运输包装上,Article 27第4条写道:
UDI carriers shall be placed on the label of the device and on all higher levels of packaging. Higher levels of packaging shall not be understood to include shipping containers.
UDI载体应添加在该器械标签和所有更大包装上。较大的包装不包括海运集装箱
根据IMDRF/UDI WG/N48FINAL:2019-示意图
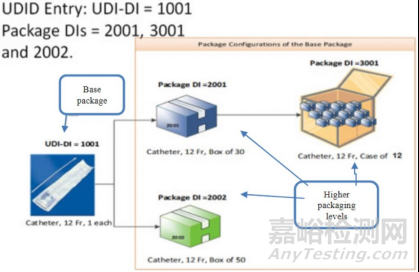
UDI 除了放在最小包装外,也要放在 Each packaging level,且不同包装、不同包装层级的 UDI-DI 也不同 (The UDI-DI of each package level requiring UDI must be unique to distinguish between package quantities at each package level-IMDRF/UDI WG/N48FINAL:2019 sec.7.1 )
有关包装层级和UDI的关系,可参考中国物品编码中心-医疗器械唯一标识(UDI)实施-常见问题的2.4。
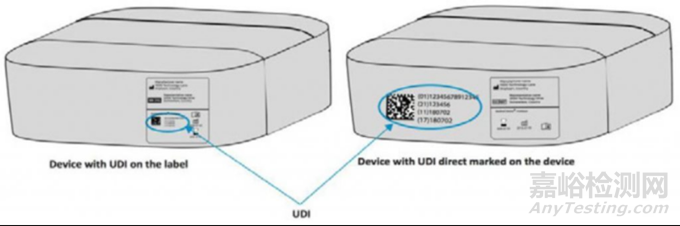
UDI 载体一般会印在标签上,之后再贴到产品/包装,但Direct Marking (永久标识)特别要求将UDI载体直接印再医疗器械上。
IMDRF/UDI WG/N48FINAL:2019指南上的实例,左图是常见印在标签上的,右图是直接印在医疗器械上的Direct Marking
上文提到的在器械上的UDI载体也有多种方式呈现,IMDRF/UDI WG/N48FINAL:2019-6.5.1写道:
Direct marking is the preferred solution for placing the UDI Carrier on the device itself in the case of reusable devices. There are a variety of methods for applying direct marking, including both intrusive methods (e.g., dot pin; etching; direct laser marking; etc.) and non-intrusive methods (e.g., cast/forge/mold; laser bonding; stencil; permanent adhesive label; etc.).
对于可重复使用的器械,直接标记是将 UDI 载体置于器械本身的首选解决方案。直接打标有多种方法,包括侵入式方法(如点针、蚀刻、直接激光打标等)和非侵入式方法(如铸造/锻造/模具、激光粘合、模板、永久性粘合标签等)。
5.Basic UDI-DI到底是啥?有什么特色功能?
初看Basic-UDI-DI时,一定会有人忽略Basic一词,认为Basic UDI-DI就是一般常见的UDI。但是,Basic-UDI-DI其实是一个特别的识别码(Identifier),与UDI-DI/UDI-PI不同。
Basic UDI-DI 不是单一产品的编号,而是一组类型产品的识别码(Product family identifier),一个Basic-UDI-DI 下一个或多个 UDI-DI (Grouping one or more UDI-DI child identifiers),但一个 UDI-DI 只能属于一个Basic-UDI-DI。
换句话说,一个Basic UDI-DI可能涵盖很多器械,例如一个证书上可能包含多种产品型号,例如,10/50/100 的口罩、不同颜色、不同大小,虽有各自有不同的 UDI-DI,但都是同一个Basic UDI-DI。
MDR Annex VI Part C中写道:
“Basic UDI-DI是器械类别(此处 model 没有翻译成规格或型号)的主要标识符。Basic UDI-DI是在器械使用单元的层面上分配的 DI。Basic UDI-DI是在 UDI数据库中记录的主要的关键,也应在相关的证书和欧盟符合性声明中引用。The Basic UDl-Dl is the primary identifier of a device model. It is the Dl assigned at thelevel of the device unit of use. It is the main key for records in the UDl database and isreferenced in relevant certificates and EU declarations of conformity”
MDCG 2018-1 Rev.4 Guidance on BASIC UDI-DI and changes to UDI-DI写道:
“Basic UDI-DI的功能是:The Basic UDI-DI is the main key in the database and relevant documentation (e.g. certificates, declaration of conformity, technical documentation and summary of safety and clinical performance) to connect devices with same intended purpose, risk class and essential design and manufacturing characteristics.Basic UDI-DI 是数据库和相关文件(如证书、合格声明、技术文件以及安全和临床表现摘要)的主要关键,用于连接具有相同预期用途、风险等级以及基本设计和制造特征的设备。”
Basic UDI-DI 和标签、包装上所贴附的 UDI (UDI-DI & UDI-PI) 是两个不同的东西。
Basic UDI-DI只要求编号,不会出现在产品包装、标签上,只会出现在 Eudamed、EU technical documentation (e.g. SS(C)P、PSUR、CFS) 和下列的欧盟证书:
-EU-DoC
-Technical documentation
-Certificates issued by notified bodies
-Summary of safety and clinical performance (SSCP)
-Free Sales Certificates (FSC)
-Manufacturer Incident Report (MIR)
而 UDI (UDI-DI & UDI-PI),必须标识在产品标签、包装上。
6.1 多个产品是否可用同一个 Basic UDI-DI?
不同产品可以共用 Basic UDI-DI,但不是随便的产品都可以共用Basic UDI-DI。
MDCG 2018-1 rev.1写道:
“The Basic UDI-DI The Basic UDI-DI is the main key in the database and relevant documentation (e.g. certificates, declaration of conformity, technical documentation and summary of safety and clinical performance) to connect devices with same intended purpose, risk class and essential design and manufacturing characteristics
Basic UDI-DI 是数据库和相关文件(如证书、合格声明、技术文件以及安全和临床表现摘要)中的主要密钥,用于连接具有相同预期用途、风险等级以及基本设计和制造特征的设备。”
6.2 Basic UDI-DI 的编码原则


来源:北京倍力医疗技术服务有


