您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-08-03 09:35
引言:
大多数致病病原都是通过黏膜途径入侵和感染人体的。人体在黏膜自然感染过程中通常可建立起病原特异的黏膜免疫,有效预防感染的再发生。利用机体黏膜免疫应答机制研发的黏膜疫苗,可在建立系统免疫的同时也建立起黏膜免疫,真正发挥人体黏膜免疫第一道防线预防感染的作用。近年来,对疫苗预防感染的认识和要求不断提高,黏膜疫苗也成为现今全球疫苗研发的热点。自2019年底暴发COVID-19,SARS-CoV-2在全球流行。世卫组织于2020年3月宣布COVID-19为国际关注的突发公共卫生事件(PHEIC),直至2022年5月才宣布COVID-19不再构成PHEIC。世卫组织在其官方网站明确指出了COVID-19的有关事实:1,COVID-19是一种由病毒引起的疾病。2. 大多数人不需要住院治疗就能完全康复。有严重症状的人应尽快就医。3. 自2019年12月以来,全世界记录了超过7.6亿病例和690万例死亡,但实际数字被认为更高。4. 截至2023年6月,已接种130多亿剂疫苗。
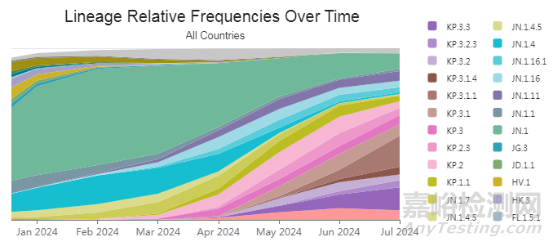
图1. 2024年来SARS-CoV-2毒株的流行变化情况 (源自GISAID网站2024.07.12)
事实上,无论对于呼吸道感染和传播的病毒,还是消化道、乃至泌尿生殖道感染和传播的病毒,研发广谱高效的黏膜疫苗,才能更有效实现病毒感染和传播的预防和控制。
疫苗研发和免疫:
过去100年来,公共卫生领域在“卫生”和“疫苗接种”两个方面取得的伟大成就显著减少了病原微生物对人类健康的威胁。尤其是疫苗接种有针对性地加强了人类预防多种感染性疾病的能力。
人类在数千年的医学实践中摸索积累了一些预防和治疗感染性疾病的方法,在近代开创了从实践到理论的疫苗学发展历史。随着生命科学技术的发展,尤其是基因工程技术在疫苗研发中的应用,推动了疫苗研发新技术的不断推陈出新,极大促进了疫苗的研发与产业化应用的发展进程。
根据疫苗免疫原类别和采用的技术,通常将疫苗分为减毒活疫苗、灭活疫苗、亚单位疫苗、载体疫苗、DNA疫苗、RNA疫苗、多糖疫苗等。中国本土的疫苗研发和应用在近二十多年来有十分显著的发展和进步。上述各类疫苗都有相关的研发机构以及疫苗企业在采用和推进。疫苗所针对的疾病类别也从感染性传染性疾病延伸到非感染性疾病,如肿瘤疫苗、高血压疫苗等。原始创新型疫苗研究的投入、专业从事疫苗研发和产业化的机构和企业数量也在快速增长。这些变化无论从数量还是质量上都反映出中国在疫苗领域的发展和壮大。
2020年以来新冠疫情的暴发催生了mRNA疫苗空前快速的临床应用,也成为近年来最受大众和业界期待的疫苗类型,这种期待延伸到mRNA疫苗在各种疾病防治中的应用,具有广泛的应用前景。
除mRNA疫苗外,GSK和辉瑞以prefusion F为靶标的呼吸道合胞病毒(RSV)疫苗在60岁以上老年人群的三期临床试验取得积极成果,并于2023年相继批准上市,给业界以极大鼓舞。这也给RSV疫苗过去半个多世纪以来临床试验反复失败的历史画上了一个句号。中国许多疫苗企业也在RSV疫苗研发一线上快速积极跟进。
黏膜疫苗现状:
黏膜疫苗大家应该并不陌生。例如,减毒脊髓灰质炎病毒疫苗,即大家熟悉的“口服糖丸”就是一种不用打针、通过口服激活胃肠道黏膜免疫应答的黏膜疫苗。口服脊髓灰质炎病毒疫苗比注射型的灭活疫苗具有更高的抗病毒保护效力,对中国有效控制脊髓灰质炎病毒感染流行发挥了重要作用。还有一种通过鼻腔喷雾接种的减毒流感病毒疫苗,也是一种典型的黏膜疫苗。2022年批准紧急使用的“吸入式”腺病毒载体新冠病毒疫苗,则是黏膜疫苗新型接种模式的一种尝试。之所以采用“口服”、“喷鼻”、或者“吸入”,是因为只有通过黏膜途径接种,才能诱导有效的黏膜免疫应答,提高黏膜免疫防线的特异防御能力。
但是,上述提到的黏膜疫苗类型都有一个共同特点,即都是“活”疫苗,“减毒活疫苗”、或者“活病毒载体疫苗”。这类活疫苗往往存在一些安全性的担忧,而采用安全性高的“死”疫苗(比如灭活或者蛋白亚单位)通过黏膜途径接种则往往效力低下!
尽管黏膜疫苗的优点和好处大家都知道,而黏膜疫苗的应用却仅限于上述提到的几种“活”病毒疫苗。因此,黏膜疫苗未来发展与应用的挑战在于必须兼顾安全性和有效性,在技术上寻求突破。只有这样,黏膜疫苗才能更好地推广应用到更多类别的疫苗,预防更多的疾病。
黏膜疫苗展望:
新冠疫苗的快速研制和临床应用打破了疫苗发展史的记录。疫情发生后,灭活疫苗、mRNA疫苗、病毒载体疫苗、亚单位蛋白疫苗快速研发推出进入临床应用。自第一剂新冠疫苗接种三年多的时间内,全球已接种近130亿剂次,仅中国就接种了30多亿剂次。但是,病毒的感染和传播、国际上的疫情在当时并没有得到有效控制。从“疫苗接种是最有效和经济的控制传染病流行的方式“这一观点来看,以注射型的新冠疫苗接种为主的免疫策略显然没有发挥预期的作用。主要原因就在于注射型疫苗不能诱导上呼吸道的黏膜免疫应答,尤其是上呼吸道特异分泌型IgA抗体应答,因而缺乏阻止新冠病毒早期在上呼吸道黏膜上皮细胞入侵、复制和传播的能力[1](图2),这也是呼吸道感染和传播的病毒给人体免疫提出的一个重要挑战。
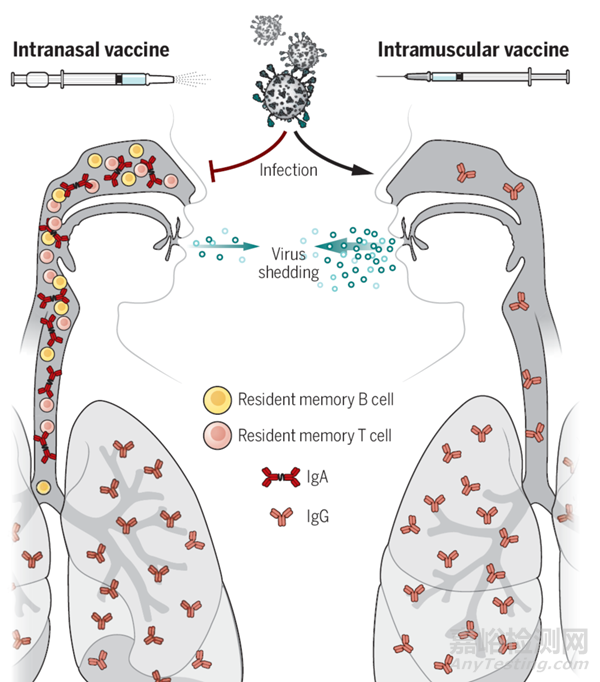
图2. 经鼻腔接种的疫苗既可以如同注射型疫苗引起系统免疫反应,又可在黏膜局部诱导保护性的分泌型IgA抗体和细胞免疫应答[1](Science 2021, 373 (6553), 397-399)
作为国际上第一个批准紧急使用的“吸入式”腺病毒载体新冠病毒疫苗,在中国部分地区推广接种,显示了黏膜免疫策略的作用。
在减毒病毒黏膜疫苗和病毒载体黏膜疫苗基础上,研发安全有效的黏膜佐剂,帮助更为安全的亚单位蛋白疫苗通过黏膜接种诱导有效的黏膜免疫应答和保护,是未来实现疫苗更安全、更有效、更便捷接种的一个方向。
基于霍乱毒素CTB的黏膜佐剂研究验证了其有效的黏膜佐剂效应和作用。对CTB分子进行点突变降低其毒性和副作用是研发人员努力的一大目标。基于Toll样受体激活配体的黏膜佐剂研发也在不断推进。例如,Toll样受体3(TLR3)的配体PolyI:C和Toll样受体9(TLR9)的配体CpG通过黏膜接种均可一定程度诱导黏膜免疫应答。基于Toll样受体5(TLR5)的配体—鞭毛素,则是一种独特的蛋白类配体。我们经过多年研究,探索了重组鞭毛素蛋白黏膜佐剂活性特征和鼻腔接种的免疫策略,证明了重组鞭毛素蛋白独特的黏膜免疫激活特性和效应机制,并应用于龋齿和RSV亚单位黏膜疫苗的设计和研发。此外,我们设计了针对冠状病毒受体结合域(RBD)靶标的亚单位重组蛋白黏膜疫苗,证明了在重组鞭毛素蛋白佐剂帮助下,多价的新冠病毒RBD重组蛋白通过鼻内免疫可高效诱导出上呼吸道黏膜的免疫反应和特异的分泌型IgA抗体应答,显著增强了上呼吸道对新冠病毒株的中和活性[2-4]。在小鼠体内,该疫苗显示出极为引人注目的长效中和抗体和长寿浆细胞应答(图3)。后续的研究者发起的临床试验也初步显示,该亚单位黏膜疫苗具有良好的安全性和免疫原性。
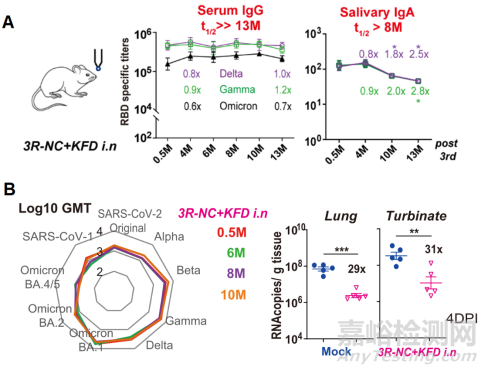
图3. 多价的新冠病毒RBD黏膜疫苗3R-NC联合鞭毛素蛋白佐剂KFD经滴鼻免疫可在小鼠体内诱导广谱、长效的保护性应答[2](Signal Transduct Target Ther. 2024 Apr 27;9(1):114.)
鉴于黏膜疫苗极大的应用前景,国际国内都越来越重视黏膜疫苗的研发。开展黏膜疫苗研究的团队也越来越多,相关黏膜免疫的技术平台也将得到不断发展和完善。相信黏膜疫苗研发在未来将快速发展并大放异彩,在传染病预防和控制中发挥更重要的作用。
参考文献:
1.Lund, F.E. and T.D. Randall, Scent of a vaccine. Science, 2021. 373(6553): p. 397-399.
2. Li, X., et al., Nasal vaccination of triple-RBD scaffold protein with flagellin elicits long-term protection against SARS-CoV-2 variants including JN.1. Signal Transduct Target Ther, 2024. 9(1): p. 114.
3. Yang, J., et al., The protective nasal boosting of a triple-RBD subunit vaccine against SARS-CoV-2 following inactivated virus vaccination. Signal Transduct Target Ther, 2023. 8(1): p. 151.
4. Yang, J., et al., A triple-RBD-based mucosal vaccine provides broad protection against SARS-CoV-2 variants of concern. Cell Mol Immunol, 2022. 19(11): p. 1279-1289.

来源:Internet


