您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-12-07 14:33
摘 要 / Abstract
作为经济有效的卫生干预手段之一,疫苗预防接种在控制和消灭传染性疾病方面发挥着至关重要的作用。根据免疫程序,及时完成接种可以确保机体产生有效的免疫反应。相较于单一疫苗,集多种抗原为一体的联合疫苗减少了因多针次接种而造成的不便,提升了接种覆盖率,筑牢了免疫防线,为保障公众卫生发挥了积极作用。随着相关学科和制备技术的不断发展,越来越多的疫苗产品组合问世,在世界各国及地区的免疫规划中发挥着至关重要的支撑作用。本文从联合疫苗研发历史及其优势、研发现状和趋势以及面临的挑战等方面进行概述,以期为我国联合疫苗的研发提供相应参考。
As a cost-effective health intervention, vaccination plays a vital role in controlling and eradicating infectious diseases. Following the immunization schedule and performing vaccination in a timely manner can ensure that the body generates an effective immune response. Compared with stand-alone vaccines, combined vaccines integrate multiple antigens, reduce the inconveniences caused by multiple injections, improve vaccination coverage, consolidate the immune barrier, and contribute positively to public health. With the continuous development of relevant disciplines and vaccine preparation technologies, an increasing number of combined vaccine products are being introduced, serving as essential components in immunization programs worldwide. This article summarizes the history and advantages of combined vaccines, the current status and trends in research and development, and the challenges faced, aiming to provide a reference for the development of combined vaccines in China.
关 键 词 / Key words
联合疫苗;单一疫苗;免疫接种;覆盖率;研发
combined vaccines; stand-alone vaccines; immunization; coverage; research and development
联合疫苗是指由两个或以上活的、灭活的病原微生物或抗原成分联合配制而成的疫苗,包括多联疫苗(用于预防不同病原微生物所引起的疾病)和多价疫苗(用于预防同一种病原微生物的不同型别所引起的疾病)[1]。经过多年发展,联合疫苗制备技术已经日趋成熟,常见的品种有基于百日咳、白喉、破伤风(以下简称百白破)和麻疹、腮腺炎、风疹(以下简称麻腮风)的多联疫苗,以及基于脑膜炎球菌、人乳头瘤病毒、流感病毒、肠道病毒等的多价疫苗。联合疫苗的成功问世和普及推广极大促进了世界各国及地区免疫规划工作的开展,并在一定程度上决定了免疫程序的设置,对公共卫生和公众健康有着极为重要的意义。随着科学技术的不断进步,新的联合疫苗不断涌现。回顾联合疫苗的研发历史,总结其优势,对代表产品的研发现状和趋势以及面临的挑战等进行分析总结,有助于推动我国联合疫苗产业的发展。
1、联合疫苗的研发历史及优势
1.1 联合疫苗的研发历史
在成功发明针对单个病原微生物的疫苗后,科学家们开始考虑将不同品种进行联合接种的问题,这些富有胆识的研究和尝试为联合疫苗的诞生奠定了坚实基础。随着20 世纪20 年代白喉类毒素和破伤风类毒素的成功研制,科学家们开始着手研究这两个类毒素联合使用的问题。1945 年,三价流感病毒疫苗问世,这是最早获批使用的联合疫苗。作为第2 个联合疫苗品种,1947 年六价肺炎球菌多糖疫苗成为最早获批上市的细菌性联合疫苗。接下来获得上市许可的有:全细胞百白破联合疫苗(DTwP,1948 年)、三价脊髓灰质炎灭活疫苗(IPV,1955 年)、口服三价脊髓灰质炎减毒活疫苗(OPV,1963 年)、麻腮风联合疫苗/ 麻疹风疹联合疫苗(MMR/MR,1971 年)和四价脑膜炎球菌多糖疫苗(1978 年)[2]。此后,以百白破(DTP)疫苗为基础,加入IPV、b 型流感嗜血杆菌(Hib)或乙型肝炎(HepB)等成分在内的多联疫苗以不同组合形式呈现,逐渐进入市场。截至目前,联合程度最高的品种是由葛兰素史克研发的婴护宁六合一疫苗(InfanrixTM hexa),包含白喉、破伤风、无细胞百日咳、HepB、IPV 和Hib 共6种成分[3]。
1.2 联合疫苗的优势
早在1990 年, 由世界卫生组织(World Health Organization,WHO)、联合国儿童基金会(United Nations International Children's Emergency Fund,UNICEF)、联合国开发计划署(United Nations Development Programme,UNDP)、世界银行(World Bank) 和洛克菲勒基金会(Rockefeller Foundation) 联合发起的儿童疫苗计划(Children's Vaccine Initiative,CVI)就明确提出了关于儿童理想疫苗的具体要求。采用新型技术联合多种抗原成分制成疫苗便是其中一个标准[4]。联合疫苗由于具有广泛的实际应用价值,越来越受到业界相关机构的认可,诸如WHO[5]、全球疫苗免疫联盟(Global Alliance for Vaccines and Immunisation,GAVI)[6]、美国免疫实践咨询委员会(Advisory Committee on Immunization Practices,ACIP)[7-8] 等。在我国,《疫苗管理法》[9]、《“十四五”生物经济发展规划》[10] 等明确支持多联多价疫苗的研制。
随着国家免疫规划的发展,在新生儿出生后两年内需要接种的疫苗品种不断增加。以我国为例,根据《国家免疫规划疫苗儿童免疫程序表(2021年版)》(表1),2 岁前的新生儿至少需要接种18针次疫苗,且不包含第二类疫苗接种的数量。若使用联合疫苗,则可以有效简化接种程序,减少疫苗接种的次数。
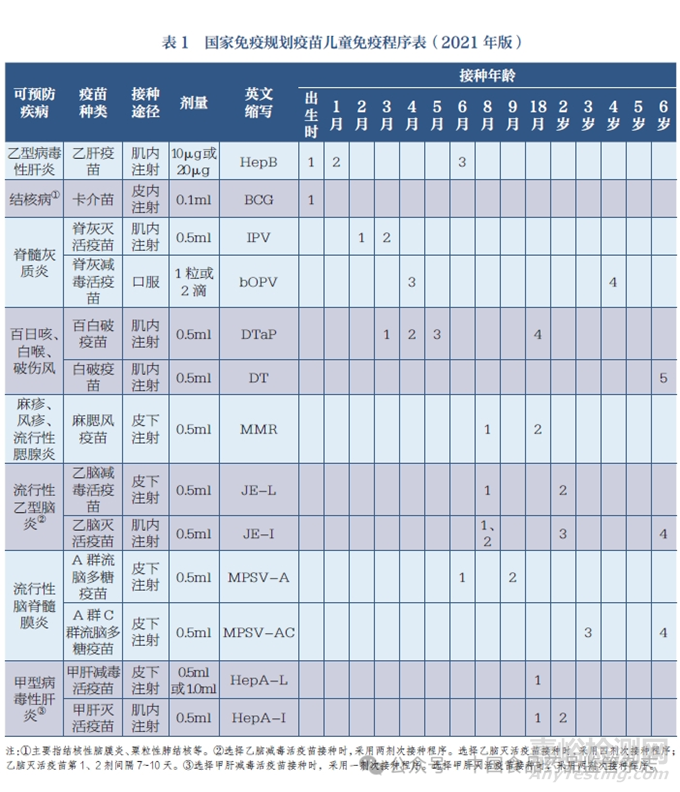
在疫苗接种过程中,受种者根据接种程序按时完成全程接种可视为具备良好的依从性。无论是在国内还是国外,在一种疫苗接种过程中需要多针次的接种可能会对儿童监护人的接种意愿和配合程度造成影响,降低疫苗接种的依从性。一项关于美国费城儿童免疫接种的调查研究显示,在一次就诊过程中完成两针次的接种人数比例为99.5%,完成五针次的接种人数比例为88.9%,明显可见多针次接种所引发的依从性下降[11]。在Kalies 等[12]采用电话采访评估联合疫苗对接种时效影响的调查研究中发现,更多的接种者倾向于选择使用联合疫苗;采用多价联合疫苗可有效确保及时完成接种,缩短了完成免疫接种程序的时限。相较于采用单价疫苗按时完成整个Hib 疫苗免疫程序的儿童比例(13.3%),采用四价、五价或六价疫苗完成免疫的儿童比例大幅提升(分别为17.8%、27.7%和39.1%)。除Hib 疫苗外,采用联合疫苗按时完成脊髓灰质炎疫苗和HepB 疫苗接种的比例也明显优于单价疫苗。Happe 等[13] 在调查研究中发现,高价次的联合疫苗有助于确保及时接种,同时有效缩短了延迟疫苗接种的累积天数。尽管所接种的联合疫苗中未包含Hib 疫苗,但在使用无细胞百白破(DTaP)/HepB/IPV 疫苗进行免疫后,按时完成Hib 疫苗接种的比例(49.3%)高于未接受任何一剂联合疫苗免疫时的比例(42.6%)。Kurosky 等[14] 对2012 年美国国家免疫调查接种数据分析显示,相较于接受单一疫苗免疫的儿童,接种至少一剂联合疫苗的儿童有着更高的疫苗接种完成率和更好的依从性。由此可见,使用联合疫苗可以有效改善接种依从性。
针对多个国家和地区的调查研究显示,使用联合疫苗可以有效降低疫苗接种的相关费用。在对儿童进行Hib 免疫接种的成本效益分析中,Bärnighausen 等[15] 发现在五价、四价联合疫苗中添加一剂Hib 疫苗的成本分别约为2.8 美元、3.1 美元。但如果是采用单独接种的方式,成本约为3.4 美元,远高于以联合疫苗的形式进行接种。由Min 等[16] 在韩国开展的一项对比研究显示,相较于目前使用五联疫苗和额外进行HepB 疫苗接种的免疫方式,使用六联疫苗时每个婴儿的接种费用可以减少47 155 韩元(按当时汇率约合36.22 美元);若按出生人数总量为260 500人计算,可节省120 多亿韩元(按当时汇率约合9 236 417 美元)。联合疫苗在为儿童受种者、监护人和医务人员提供极大便利的同时,也有效降低了疫苗接种相关的社会总成本。其他相关研究也同样证明,六联疫苗的使用有效降低了疫苗接种产生的直接和间接费用及社会成本[17]。
免疫覆盖率是确保免疫规划或卫生健康系统有效运作的一大指标[18]。一系列针对联合疫苗使用的研究发现,采用联合疫苗可以有效提升免疫覆盖率。例如,比利时法语社区纳入四价疫苗(DTPHib)后,DTP 的免疫覆盖率上涨了8%[18-19]。通过使用联合疫苗, 意大利的百日咳、MMR 和Hib 疫苗免疫覆盖率从50% 上涨至88%[18,20]。Marshall 等[21] 调查研究发现,联合疫苗的使用有效提升了美国医疗补助计划覆盖人群中的接种覆盖率。除由医疗补助对疫苗接种进行补贴外,一项由私人保险负担美国儿童接种含DTaP 联合疫苗的研究显示,接种联合疫苗的儿童无论是完成全程四剂次免疫,还是按时完成免疫的比例均高于接种单苗的儿童[22]。
六联疫苗作为目前世界上联合程度最高的疫苗品种,已被全球多个国家或地区纳入免疫规划。2023 年,一种六联疫苗品种在我国获批进行临床前研究,目前正在接受国家药品监督管理局的审核。在此背景下,一项在我国开展的、围绕六联疫苗(DTaP-HepB-IPV-Hib)接受度和接种意愿的横断面调查研究显示,尽管该疫苗将作为第二类疫苗获批,但仍有约75% 的家长愿意为其子女选择该疫苗进行接种,可见更高价次的联合疫苗有效提升了接种意愿[23]。
综上,接种联合疫苗具有简化免疫接种程序、减少疫苗接种次数、增加接种者依从性、降低接种费用、提高疫苗覆盖率、提升接种意愿等优势[18,24],通过相对简单的接种便可达到“一针多防”的效果,具备不可估量的临床价值、经济价值和人文价值[25],已成为当今市场上的优先选择和疫苗研发的必然趋势[26],具有十分广阔的市场前景。
2、联合疫苗的研发现状及趋势
2.1 传统经典联合疫苗
2.1.1 百白破联合疫苗的发展
将白喉、破伤风、百日咳3 种不同成分进行联合而形成的疫苗产品已经成为过去几十年间使用最为广泛的多联疫苗,早期针对单个病原的分离和相关研发工作为其诞生打下了坚实基础。1883 年,埃德温·克勒布斯首次通过染色描述了白喉膜的特征。1 年后,弗里德里希·洛夫勒培养分离得到白喉棒状杆菌。1889 年,北里柴三郎成功培养并分离出破伤风梭状芽孢杆菌。1897 年,保罗·埃尔利希开发出一种标准化白喉抗毒素单位的方法。1901 年,埃米尔·阿道夫·冯·贝林因开发血清疗法获得诺贝尔生理学或医学奖。1906 年,朱尔斯·博代和奥克塔夫·根古从患儿的痰液中分离培养出百日咳鲍特菌。1914 年,首款全细胞百日咳疫苗在美国获得上市许可。1923 年,加斯顿·拉蒙使用甲醛灭活法成功研制出可以单独使用(不需要同抗毒素联合注射)的白喉类毒素疫苗;1926年,他和克里斯蒂安·策勒采用同样的方法成功制备出破伤风类毒素疫苗。同年,亚历山大·托马斯·格伦尼使用明矾提高了白喉类毒素疫苗的有效性。1938 年,科学家通过将破伤风类毒素吸附在铝佐剂上制成了有效的疫苗。1939 年,世界上第一种有效的百日咳疫苗诞生。
在早期的研发过程中,科学家们发现全细胞百日咳的细胞壁含有脂多糖,可以充当佐剂角色,有效提升了类毒素产生的免疫原性。同时,成分中用于沉淀类毒素的铝盐不仅提高了全细胞百日咳疫苗的免疫原性,也降低了不良反应的严重程度[27]。1943 年,DTwP 在美国完成研制,于1948 年获批上市[2]。然而,DTwP 接种产生的不良反应引发了人们的广泛关注,其接种率不断下降,造成部分国家和地区百日咳的暴发[2,28-30]。随着人们对于百日咳鲍特菌的深入了解,无细胞百日咳疫苗的研发进程加快。1981 年,佐藤裕二及其同事成功研制出无细胞百日咳疫苗[31]。1996 年,含有5 种抗原成分的无细胞百日咳疫苗也在美国及其他国家和地区获批上市[2,32]。相较于全细胞百日咳疫苗,无细胞百日咳疫苗仅含有特定的细菌成分,不含容易催生不良反应的脂多糖。目前,无细胞百日咳疫苗是美国唯一获得上市许可的百日咳疫苗[33]。虽然DTaP 疫苗成功避免了脂多糖所催生的不良反应,但其免疫持久性较差,且共纯化工艺不能做到对抗原成分的精准定量,对于生产制备、质量控制和临床接种都带来了一定的挑战。1991 年,采用组分纯化的DTaP 疫苗在美国成功问世[34]。相较于共纯化工艺,通过对各抗原进行单独纯化后按比例配制而成的疫苗工艺更为可控、安全性更好。目前,我国有多家疫苗生产企业正在开展该品种的研发工作,但尚未有产品获批上市。
作为历史最悠久、使用最广泛的联合疫苗品种,DTP 疫苗在WHO 的提倡和各国及地区监管部门的努力下相继被纳入各国及地区的计划免疫范畴,在全球范围内达到了极高程度的普及。如今,以DTwP 或DTaP 为基础,联合IPV、Hib、HepB等在内的四联、五联或者六联疫苗已成为世界上诸多知名疫苗生产企业(如赛诺菲巴斯德、葛兰素史克等)的重磅产品或研发热点,以及WHO 预认证的优先品种[35]。随着制备技术的优化、研究开发的深入,未来将会有更多的组合形式、具备更好安全性和有效性的产品问世。
2.1.2 麻腮风联合疫苗的发展
除以百白破为主的联合疫苗外,另外一个重要的联合疫苗品种是预防麻疹、腮腺炎和风疹的MMR 疫苗。不同于采用灭活技术的DTP 疫苗,MMR 疫苗属于减毒活疫苗之间的联合。
麻疹、腮腺炎、风疹均是由病毒感染引发的急性传染病。1954 年,约翰·恩德斯和托马斯·皮布尔斯从人和猴肾的组织培养中分离得到麻疹病毒,为麻疹疫苗的研究和制备奠定了基础。在麻疹疫苗被发明前,世界各地均发生过麻疹流行,严重危害人类的生命安全。1963 年,两种麻疹疫苗在美国首先获得上市许可,分别为辉瑞基于灭活病毒技术路线的疫苗(Pfizer-Vax Measles-K)和默沙东基于减毒活技术路线的疫苗(Rebeovax)[36]。20 世纪60 年代,莫里斯·希勒曼通过鸡胚传代减毒的方法成功研制出腮腺炎疫苗,1967 年获批上市后得到了广泛运用[2,37]。1969 年,全球首个风疹疫苗获得上市许可[38]。以上基于单个病原的疫苗研究为1971 年莫里斯·希勒曼将麻疹、腮腺炎和风疹的减毒活疫苗联合为一针接种(即MMR疫苗)奠定了基础。3 种疫苗联合接种在保留各疫苗效力的同时,并未产生额外的不良反应。同年,该疫苗在美国获批上市,成为全球第一款预防麻疹、腮腺炎和风疹的联合疫苗[39]。我国单个品种的麻疹疫苗、腮腺炎疫苗和风疹疫苗分别于1965年试制成功、1997 年获正式生产文号、1993 年获生产文号[40]。2000 年,我国首个MMR 疫苗由北京生物制品研究所完成临床研究;2002 年获生产文号,由北京天坛生物制品公司负责生产[39]。2007 年,我国将MMR 疫苗纳入国家免疫规划[41]。根据疾病防控需要,2020 年国家对免疫程序进行调整,在8 月龄和18 月龄时各接种1 剂MMR 疫苗。随着疫苗接种的大规模普及,近年来上述3 种疾病的发病率已成功下降至较低水平。
在过去几十年内,MMR 疫苗一直以“三联”的形式保持稳定使用。近年来,以葛兰素史克和默沙东为代表的企业成功研发出联合水痘疫苗在内的麻腮风- 水痘四联疫苗(MMRV),如葛兰素史克的Priorix Tetra[42] 和默沙东的ProQuad[43]。现阶段,许多疫苗生产企业除考虑兼顾免疫程序,同其他疫苗联合以实现更广的覆盖范围外,也在考虑对疫苗株进行优化,从而提升免疫效果和安全性。
2.2 以呼吸系统疾病为基础的联合疫苗
2.2.1 脑膜炎球菌联合疫苗的发展
流行性脑脊髓膜炎(常被称为流脑)是感染脑膜炎奈瑟菌(简称为脑膜炎球菌)后引发的急性呼吸道传染病,具有发病急、传染性强等特点。最早有记载的流行性脑脊髓膜炎流行发生在1805 年瑞士日内瓦[2,44] ;第二年,在美国的马萨诸塞州也暴发了同样的疾病[2,45];随后逐渐成为全球流行疾病,对人类的健康造成严重影响。1887 年,安东·魏切尔鲍姆首次分离培养得到脑膜炎球菌。在发病初期,流行性脑脊髓膜炎同其他病毒性或细菌性感染类似,常出现发热、皮疹等情况,无特殊的临床表现,但病情容易在短期内迅速恶化,严重时可危及生命,部分康复患者会伴有永久性的后遗症。WHO 在《到2030 年战胜脑膜炎:全球路线图》(Defeating Meningitis by 2030: A Global Road Map)中提出倡议,消除脑膜炎作为流行病流行;通过疫苗接种,降低由脑膜炎造成的死亡率[46]。
根据该菌体多糖的免疫化学特征,目前有13个不同血清群的脑膜炎球菌,其中具有荚膜的A、B、C、W135、X 和Y 群脑膜炎球菌是导致脑膜炎球菌性疾病的主要病原体[2,47]。由于其自身结构特点,膜菌群容易变化,从而造成流行菌的变异,形成新的流行态势;不同国家和地区的主要流行情况不尽相同,也给疫苗研发带来了不小的挑战。
脑膜炎球菌疫苗的研发历程较为坎坷。全菌体灭活脑膜炎球菌疫苗作为早期开发的产品,首先在军队中展开接种;在1900~1940 年间开展的临床试验因无法证明疫苗的保护效果而被迫终止。此后,采用灭活技术路线同样以失败告终。随着抗生素治疗手段的广泛运用,脑膜炎球菌疫苗的研发工作一度停滞,直至20 世纪60 年代,由于抗磺胺类药物的耐药菌株大量出现,在军队中造成严重的健康威胁,才再次开启研究热潮。20 世纪70 年代,A 群和C 群脑膜炎球菌多糖疫苗虽已被研制出,但在2 岁以下婴幼儿中不能形成有效的免疫应答,其免疫持久性也有待考证。2015 年,两种四价脑膜炎球菌多糖蛋白结合疫苗(含A、C、W 和Y 群)在美国获批上市[2]。
脑膜炎球菌疫苗的技术路线分为多糖疫苗和多糖蛋白结合疫苗。多糖疫苗虽然具有良好的安全性,在儿童和成年人中拥有较好的有效性和免疫原性,但因其在婴幼儿中的免疫原性较差,不具备多糖蛋白结合疫苗的优势,有可能逐渐被替代。据美国ACIP 发布的使用建议,脑膜炎球菌多糖蛋白结合疫苗被认为优于非结合的多糖疫苗[48]。在我国,2000 年研制出的A+C 群脑膜炎球菌多糖疫苗于2007 年被纳入国家免疫规划。除此之外,ACYW群脑膜炎球菌多糖疫苗(2006 年)、A+C 群脑膜炎球菌多糖结合疫苗(2006 年)、ACYW 群脑膜炎球菌多糖结合疫苗(2021 年)也是市场上可供选择的疫苗产品。在脑膜炎球菌疫苗的基础上,A群C 群脑膜炎球菌(结合)b 型流感嗜血杆菌(结合)联合疫苗于2014 年被成功研制[49]。2021 年,康希诺研发的曼海欣(ACYW135 群脑膜炎球菌多糖结合疫苗)作为我国首个自主研发的四价流脑结合疫苗获批上市[50]。
由于不同技术路线疫苗的接种程序不一致,实际免疫接种工作面临较大的挑战,开展序贯接种和替代接种等研究显得尤为重要。近年来,国际上成功开发出针对B 群的脑膜炎球菌疫苗,我国尚无此类产品上市[51]。在联合疫苗研究方面,美国正在开展可预防A、B、C、W、Y 群的五价脑膜炎球菌疫苗研发[52]。
2.2.2 肺炎球菌联合疫苗的发展
由肺炎链球菌引发的肺炎是常见的呼吸道疾病,所有年龄段人群均可能感染,儿童和老年人是高危易感人群。尽管抗生素可以有效治疗感染,但随着耐药菌株的出现,肺炎球菌疫苗的研发显得尤为重要。
1881 年,乔治·米勒·斯坦伯格和路易斯·巴斯德几乎同时发现了肺炎链球菌。自此,科学家们开始投入大量的时间和精力对这一病原体进行研究。19 世纪末期,针对肺炎链球菌及其感染的研究已经成为相关基础学科的重要关注点[53]。
肺炎球菌有90 多个血清型,但造成感染的仅仅是其中的部分血清型,且不同国家和地区流行的血清型有所差异。最早开始采用全菌体粗制的肺炎球菌疫苗于1911 年首次接受大规模临床试验评估。研究数据显示,疫苗的使用可以有效减少由肺炎球菌引发的肺炎[54]。那时,人们对于血清特异性免疫的重要性还不甚了解。随着研究的不断深入,1929 年,艾弗里和戈贝尔发现荚膜多糖结合蛋白质后呈现出较高的免疫原性[2,55]。随后,大量的科学研究也发现了肺炎球菌荚膜多糖血清型特异性抗体的重要作用,大大加速了多价肺炎球菌多糖疫苗的研发工作。20 世纪30~40 年代,特别是第二次世界大战期间的疫苗接种效果证明了多糖疫苗的有效性。1946 年,2 种六价肺炎球菌多糖疫苗在美国上市。然而,比起预防效果“有限”的疫苗,医生们对于能够提供治疗效果的青霉素更感兴趣,疫苗在上市后的几年内便退出了市场[2]。1964 年,罗伯特·奥斯特里安和杰罗姆·戈尔德指出虽然抗生素可以提供有效治疗,但肺炎球菌感染的严重性不容忽视,于是罗伯特·奥斯特里安再次开展了肺炎球菌多糖疫苗的研究工作[56]。从20 世纪70 年代末起,全球多个国家和地区开展了不同价次的肺炎球菌多糖疫苗临床试验。这些临床试验充分证明了疫苗的有效性,即疫苗可以作为有效预防肺炎球菌感染的手段在市场上推广。1977 年,十四价肺炎球菌多糖疫苗在美国获批上市[56]。在此基础上,疫苗配方得到优化、具备更高价次的二十三价肺炎球菌多糖疫苗于1983 年问世[56]。
由于荚膜多糖是T 细胞非依赖性抗原,肺炎球菌多糖疫苗存在一定弊端,即在2 岁以下婴幼儿中的免疫原性不是十分理想。同时,鉴于20 世纪90 年代Hib 结合疫苗显现出的有效性,科学家们开始考虑参照同样的方式,将肺炎球菌的多糖和特定的蛋白质载体进行结合,由此催生了肺炎球菌结合疫苗。2000 年,七价肺炎球菌多糖结合疫苗作为世界上第一个此类产品获批上市[57]。此后,更高价次的结合疫苗陆续问世(包括葛兰素史克的Synflorix、辉瑞的Prevenar 13)。由于载体蛋白的存在,结合疫苗展现出更具优势的免疫原性;加之对侵袭性感染的有效性,其在全球范围内获得了广泛推广。
基于功能基因组的分析,肺炎球菌含有多达500 余种表面蛋白[2]。随着科学家们对这些表面蛋白在感染中的致病机制和作用原理进行研究,相关蛋白疫苗的研发将进一步加快。相比其他技术路线,蛋白疫苗具有更理想的、针对不同荚膜血清型的交叉保护作用。
2.3 以消化道疾病为基础的联合疫苗
2.3.1 轮状病毒联合疫苗的发展
轮状病毒感染是造成婴幼儿严重急性腹泻的主要原因。因为缺乏有效的药物治疗手段,临床上通常采用口服补液、静脉输液等方式治疗轮状病毒感染,所以接种安全、有效的疫苗是有效降低轮状病毒感染发病率和死亡率的有效策略。早在2009 年,WHO 就曾建议所有国家和地区将轮状病毒疫苗纳入免疫规划,特别是在轮状病毒胃肠炎相关死亡率较高的国家和地区[58-59]。2013 年,WHO 在关于轮状病毒疫苗的立场文件中再次提倡将疫苗作为针对腹泻疾病的有效预防和治疗手段[60]。2020 年,中华预防医学会发布的《儿童轮状病毒胃肠炎免疫预防专家共识(2020 版)》中同样指出,疫苗接种是预防轮状病毒相关腹泻的有效手段[61]。
1973 年,露丝·毕夏普等通过电子显微镜发现车轮状的病毒粒子。其因具有独特的形态特征,后被正式命名为轮状病毒。根据病毒衣壳蛋白VP6 所产生的不同抗原性,轮状病毒可分为8 个组(A~H),造成人类感染的主要为A 组轮状病毒[2]。轮状病毒分类工作组将其进一步分为42 个G 和58 个P 血清型或基因型[62-63]。然而,并非所有基因型的轮状病毒都会感染人类,且感染人类的基因型会随时间、地点等因素发生变化,造成感染的主要基因型包括G9P[8]、G8P[8]、G3P[8]、G1P[8]、G2P[4]、G4P[8] 等[64]。在我国流行的主要轮状病毒基因型为G1、G2、G3、G4、G9和P[8][64-65]。此外,有研究发现接种轮状病毒疫苗后产生的保护作用会使轮状病毒流行株发生变化(发生重组或重配),有可能会造成流行型别的转换或产生新的变异株。
1998 年, 四价人- 猴重配轮状病毒疫苗RotaShield 获批上市,这是首个多价轮状病毒疫苗[66]。美国在该疫苗上市后不久便将其纳入免疫程序,但因产品使用导致的肠套叠事件于次年退出市场。通过大样本量的临床研究,默沙东研发的口服五价人- 牛重配轮状病毒减毒活疫苗RotaTeq于2006 年在美国获批上市,包含G1、G2、G3、G4 和P[8] 共5 个型别[67]。此后,多个国家和地区的卫生监管机构将该品种纳入免疫规划,使其成为目前全世界范围内使用最为广泛的轮状病毒疫苗品种。2018 年,该疫苗以乐儿德为中文商品名在我国获批上市, 包含G1、G2、G3、G4 和G9共5 个型别[68]。2017 年,印度血清研究所研发的五价人- 牛重配轮状病毒减毒活疫苗Rotasiil 在印度上市, 包含G1、G2、G3、G4 和G9 共5个型别,但使用国家及地区较为局限[2,69]。2023 年,兰州生物制品研究所研发的口服三价人- 羊重配轮状病毒减毒活疫苗在我国获得上市许可,成为我国首款自主研发的多价轮状病毒减毒活疫苗[70]。
无论是以单毒株为基础的疫苗,还是以多毒株为基础的疫苗都可以有效预防由轮状病毒引发的感染。但相较于前者,后者可以对流行的轮状病毒毒株产生更广泛的保护效果。尽管通过10 余年的疫苗使用,由轮状病毒感染导致的死亡率大幅下降,但是由于疫苗种类有限、疫苗自身的接种要求以及市场供需不平衡等,轮状病毒疫苗的普及进程较慢。由于轮状病毒可能在感染时发生重配或因重组发生基因变异而产生新的毒株,需要进一步加强各地区的流行病学监测工作,及时发现和识别流行株,避免免疫逃逸。因此,确保轮状病毒疫苗产品供应,提高接种覆盖率,针对毒株的变化情况加速相关疫苗品种的研发,以及提升产品有效性是当前面临的主要问题。同时,相关疫苗生产厂家正在采用新型技术路线开展研发工作,如灭活疫苗、重组蛋白疫苗、病毒样颗粒疫苗等。此外,采用mRNA 技术的三价轮状病毒疫苗也在研发当中[71]。目前,我国武汉生物制品研究所、科兴生物等均在进行多价轮状病毒疫苗研发工作,其中研发进程居于前列的为武汉生物制品研究所研发的口服六价重配轮状病毒活疫苗[69]。
截至目前,我国尚未将轮状病毒疫苗纳入国家免疫规划,接种率存在两极分化的情况,经济发达的地区相对较高。由于轮状病毒疫苗上市时间较短,相关普及工作还需要进一步加强,从而增进公众对于该疫苗的了解,提升其接种率,形成有效的免疫保护。
2.3.2 肠道病毒联合疫苗的发展
肠道病毒可引发婴幼儿出现包括严重神经系统疾病在内的多种临床症状[2]。目前已知的肠道病毒有100 多种血清型[2,72]。肠道病毒A 组,特别是其中的71 型为造成手足口病的主要病原体,严重威胁婴幼儿的健康和安全[73]。
手足口病多发于亚洲地区的相关国家和地区,是对亚太地区公共卫生安全造成不良影响的疾病之一[74]。2008 年,我国安徽阜阳暴发严重的手足口病疫情,经过病原体分离等一系列研究工作,研究人员发现造成感染的正是肠道病毒71 型(EVA71)[75]。除此之外,容易引发手足口病的还有柯萨奇病毒A 组6 型(CV-A6)、10 型(CV-A10)和16 型(CV-A16)等[76]。
2015 年,由中国医学科学院医学生物学研究所自主研发的EV-A71 灭活疫苗率先获批上市[77-78]。得益于疫苗的使用,近年来我国由EV-A71 引发的手足口病发病率和死亡率得到了极大程度的控制。然而,由于肠道病毒不同血清型之间没有交叉反应,针对EV-A71 的手足口病灭活疫苗无法有效预防由其他病原引起的手足口病[79]。根据流行病学相关信息,近年来我国手足口病的病原谱发生了较大变化,已由之前的EV-A71 和CV-A16占主导变为CV-A6 和CV-A10 占主导[80]。因此,研发多价手足口病疫苗迫在眉睫。目前,全球相关疫苗企业和研究机构均在开展多价手足口病疫苗的研发。除了采用传统的灭活技术路线外,近年来还有研究人员采用病毒样颗粒技术进行疫苗研发[81]。更高价次、采用新技术制备的手足口病疫苗有望于未来几年内取得成功。
2.4 人乳头瘤病毒联合疫苗的发展
作为导致宫颈癌的元凶,人乳头瘤病毒(HPV)拥有多达200 余种型别[82]。早在1976 年,楚尔·豪森就曾推断HPV 可能是造成宫颈癌的原因[83-84]。随着他和同事在20 世纪80 年代对HPV 的DNA的成功分离,以及后来通过相关的流行病学研究发现,大部分HPV 感染为良性且具有自限性;仅有12 种型别具有致癌性[2,85],对人们可能造成高危影响、较为典型的是HPV16 和HPV18[2,86-87]。1991 年,伊恩·弗雷泽和同事制备出HPV16 病毒样颗粒,使得HPV 疫苗的研发成为可能[88]。
目前,含有多型别的HPV 疫苗已成为多价疫苗的典型代表。商业化的HPV 疫苗品种均含有HPV16 和HPV18 两个高危型别。国际上,2006 年,默沙东研发的四价重组疫苗佳达修(含HPV6、HPV11、HPV16 和HPV18)成为全球首个获批上市的HPV 疫苗。2009 年,葛兰素史克研发的二价重组疫苗希瑞适(含HPV16、HPV18)获批上市。2014 年,默沙东的升级版产品九价重组疫苗佳达修(含HPV6、HPV11、HPV16、HPV18、HPV31、HPV33、HPV45、HPV52和HPV58)也获批上市[89]。2016~2018 年,以上3 个疫苗品种作为第二类疫苗被成功引入国内市场。2019 年,厦门万泰的二价疫苗馨可宁(含HPV16、HPV18) 获批上市[90] ;2022 年, 沃森生物的二价疫苗沃泽惠(含HPV16、HPV18)也获得上市许可[91]。两款产品于近年成功通过WHO 预认证,实现产品出口,在充分证明我国疫苗研发企业实力的同时,有效提升了全球HPV 疫苗的供应能力。
根据WHO 发布的关于HPV 疫苗的立场文件[92] 以及《加速消除宫颈癌全球战略》(Global Strategy to Accelerate the Elimination of Cervical Cancer as a Public Health Problem)[93-94] 等文件,在GAVI 的大力推动下以及疫苗带来的实际获益(通过简单的疫苗接种可以有效预防HPV 引发的宫颈癌)的影响下,目前HPV 疫苗已被多个国家及地区纳入免疫规划。截至目前,我国已有多个省份安排免费接种二价HPV 疫苗。随着HPV 疫苗在全球范围内的大力普及,HPV16 和HPV18 的流行率以及生殖器疣的发病率均呈现大幅下降趋势[95-97]。然而,由于疫苗价格昂贵、公众对于疫苗了解有限、接种疫苗不能防范所有型别的HPV,疫苗推广仍在一定程度上受到影响。针对现有疫苗缺陷,相关企业积极开展迭代疫苗的研发工作,如进行单剂次、更高价次、覆盖年龄更广的疫苗品种研究,采用不同表达系统、生产工艺、接种途径,简化接种程序、使价格更具优势等。在我国,万泰生物、康乐卫士、沃森生物等多家疫苗企业研发的多价HPV 疫苗均已取得积极临床进展,多款在研疫苗有望于近年投放市场使用。其中,由康乐卫士和成大生物共同研发的重组十五价HPV 疫苗已于2024 年3 月启动Ⅰ期临床试验[98],这是目前全球范围内最高价次的HPV 疫苗[99]。
3、联合疫苗研发面临的挑战
尽管联合疫苗具有诸多优点,但因涉及多种组分,并不等同于不同组分的简单混合或同时接种,在研发、生产、质量控制、临床试验和运用等环节均面临不少挑战。因此,将联合疫苗视为整体,全面考虑抗原、工艺、免疫程序、免疫和安全性等方面的相容性十分必要。
3.1 抗原的相容性
由于联合疫苗通常含有不同种类或基因型别的抗原成分,不同成分在联合过程中不可避免会发生相互作用,如果抗原成分不“兼容”,或者各类抗原的配比不理想,轻则无法产生保护效果,重则会造成严重的不良反应。因此,抗原的相容性问题是联合疫苗研发过程中首先需要考虑的问题。通过进行鉴别试验、抗原含量检测、效价检测等确保联合疫苗中每个组分或型别的疫苗符合其作为单苗或单价原液时的质量要求,是研发联合疫苗的前提条件。换言之,只有每个组分或型别符合质量要求,才能为抗原的联合奠定基础。不同抗原在联合过程中往往相互影响,因此应对不同抗原间的相互作用进行充分研究。例如,在DTwP 和IPV 联合过程中,后者的细胞基质能溶解百日咳菌体,从而降低百日咳的效力[39]。即便是同一个病原体的不同型别在联合时也会彼此干扰。由于同时接种单价的3个血清型疫苗会互相影响,OPV 是在不同血清型单价疫苗研发成功后的1~2 年才得以获批上市[2]。现阶段广泛使用的、以DTaP 为基础的联合疫苗广泛存在一个弊端,即同Hib 疫苗联合后荚膜多糖的组分聚核糖基核糖醇磷酸酯(PRP)抗体水平不高[2,24,100-101],即便是联合程度最高的六价疫苗也存在这个问题[24,102-103]。在临床前大鼠动物模型的研究中发现,在将Hib 疫苗和破伤风类毒素(TT)或将Hib 疫苗和含丝状血凝素(FHA)在内的无细胞百日咳疫苗进行联合接种时,TT 和不同无细胞百日咳同Hib 疫苗结合会导致抗PRP 反应下降,且下降的程度与将DTaP 和Hib 疫苗进行联合接种时类似[24,104]。TT 在联合疫苗中除了以组分的形式出现外,还作为Hib 疫苗结合在荚膜多糖PRP 上的载体蛋白。其之所以导致抗体水平下降,可能是因为游离未结合的TT 对Hib 疫苗中的PRP-TT 结合物造成影响,如Hib 结合抗原中TT 特异性和PRP 特异性B 细胞间的竞争,TT 特异性B 细胞通过克隆扩张抑制了PRP 反应,TT 载体蛋白通过物理方式阻止结合抗原和PRP特异性B 细胞进行结合[24,105]。在同含FHA 的无细胞百日咳疫苗进行联合接种时,抗PRP 水平下降是由于体内外产生的IL-12 和IFN-γ 产生了极强的抑制作用[24,104,106]。尽管多个研究发现Hib抗体水平下降,但这并不影响其为机体产生有效保护。除Hib 疫苗外,在一项DTaP 和HepB 疫苗联合接种的研究中发现,相较于分别接种两种疫苗,联合接种会造成HepB 抗体水平下降,但仍超过血清保护水平[24,107-108]。因此,在对不同抗原成分进行联合的过程中,不同抗原间可能会产生竞争,或形成抑制作用,也可能会受到载体蛋白的干扰。最理想的状况是不同型别或不同抗原间不存在相互干扰,即使存在干扰也应该在可接受的范围内,这是联合疫苗制备成功的前提。
3.2 工艺的相容性
在疫苗的生产过程中,通常会通过添加佐剂、防腐剂或稳定剂等增强疫苗的免疫效果或提高其稳定性。如果按照每个疫苗自身的生产工艺,仅对不同组分进行混合,会对产品造成严重影响,因此需要考虑工艺的相容性。疫苗制备过程中往往通过添加佐剂来增强免疫应答。相关研究证实,不含佐剂的IPV 疫苗在同含有铝佐剂的DTaP-HepB 疫苗联合过程中,铝佐剂并未对IPV 造成影响[109]。在增强免疫应答的同时未对各组分造成影响当然是最理想的状况,但当含有佐剂的疫苗和其他抗原发生相互作用时,有可能会对免疫应答造成影响,不一定总是发挥积极作用。作为常使用的疫苗佐剂,铝佐剂(如氢氧化铝、磷酸铝)是通过离子非共价键与灭活疫苗结合。当含铝佐剂的疫苗在同不含佐剂的疫苗进行联合时,可能会产生佐剂效用移位,降低含佐剂疫苗的免疫原性。除此之外,佐剂也有可能同另外的抗原结合,改变不含佐剂疫苗抗原的免疫应答[2]。除前文探讨的DTaP 和Hib 疫苗联合接种时抗体水平下降的原因,还有研究表明造成Hib 抗体水平下降的原因可能是佐剂。当把Hib 疫苗单独吸附到氢氧化铝佐剂上时,大鼠抗PRP 抗体水平下降5~11 倍不等[24,104]。可能得益于全细胞百日咳疫苗的“佐剂”效用,目前尚未发现使用以DTwP 为主的联合疫苗出现此类情况。故有理由推断,佐剂的存在造成了抗体水平下降。因此,在疫苗的研发和生产中必须确保不同组分的工艺相容,不会因组分间不同的生产工艺对产品质量造成影响。
3.3 免疫程序的相容性
联合疫苗和免疫程序二者相互作用、相互影响。一方面,免疫程序的设置影响着联合开发何种疫苗。如果免疫程序不一致,就暂时不具备联合的可能性。另一方面,随着越来越多的疫苗产品问世和使用,流行病学信息可能发生改变,如何在单苗和联合疫苗、上一代联合疫苗和新一代联合疫苗间进行选择,会对免疫程序的设置造成影响。在开展以DTP 为基础的联合疫苗研究时,联合Hib 疫苗是诸多疫苗生产企业的第一选择,这正是因为两者具有并不冲突的免疫程序。根据《国家免疫规划疫苗儿童免疫程序表(2021 年版)》(表1),HepB 疫苗的免疫程序为出生时和1 月龄时分别接种一剂进行基础免疫,6 月龄时接种一剂进行加强免疫;这不同于DTaP 疫苗接种程序,即3、4、5 月龄时分别接种一剂进行基础免疫,18 月龄时接种一剂进行加强免疫。是否对免疫程序进行调整,使联合HepB 疫苗在内的多联多价疫苗成为可能,仍需要相关监管政策的支持,确保免疫程序相容。除此之外,面对诸多同类联合疫苗的选择,四联、五联和六联疫苗往往含有重复成分,如果受种者事先已经接种过其中的组分,是否需要重复免疫也是值得商榷的问题[110]。
3.4 免疫的相容性
接种疫苗后产生有效的免疫原性才能为机体提供保护。如果接种联合疫苗后所形成的抗体应答水平同接种单个疫苗品种时不可比,那么疫苗的有效性将存疑。在MMR 疫苗的联合过程中,由于3种病原体均为RNA 病毒,生产工艺相似,组分间没有明显的相互干扰,研发很快取得了成功。但在MMRV 四联疫苗的研发过程中,由于水痘病毒为DNA 病毒,免疫应答易受到其他组分的干扰,通过提高水痘疫苗中的病毒抗原浓度,有效增强了接种后机体产生的抗体水平,从而在人体内形成有效的免疫反应,为该产品的联合提供了客观保障[2,39,110]。确保各组分形成有效的免疫反应,达到必要的抗体水平,做到免疫上的相容,是联合疫苗研发中需要充分研究的内容之一。
此外,有时需要添加防腐剂以确保联合疫苗中成分的稳定性,但防腐剂的存在可能会对其他组分造成影响(如硫柳汞影响IPV 效力),采取“物理隔绝”方法(将产品分装在双腔注射器内)可以有效解决物理上的免疫相容性问题[2,39]。因六联疫苗婴护宁不同抗原组分的性质存在差异,为确保疫苗的有效性和稳定性,将白喉、破伤风、无细胞百日咳、IPV 和HepB 以液体形式分装在注射器内,将Hib 以冻干粉剂的形式分装在西林瓶内;在进行接种时,需要重新配制,即将液体组分注射到西林瓶内进行重溶[111]。
3.5 安全性的相容性
无论以何种形式呈现,疫苗的安全性都是首先需要得到保证的。从风险- 获益角度分析,虽然联合疫苗可以减少接种次数,但并不意味着受种者愿意承受发生率更高的不良反应。联合疫苗中的成分往往是已经经过临床研究、大规模人群使用、拥有大量安全性数据、以单个品种上市的疫苗产品。此外,这些单个品种疫苗在上市后与其他品种疫苗进行同时接种时也积累了相关的安全性数据。在进行联合疫苗研发过程中,可以参考这些数据对安全性进行相容性评估,但这并不意味着联合疫苗不会产生新的安全性风险,仍需要在临床试验中证明联合过程不会显著降低各成分的安全性[2]。
免疫学理论和研究表明,同时暴露于多种结合抗原有可能导致免疫反应的增强或减弱[2,112-113]。联合疫苗可能产生单个疫苗品种不存在的毒力或发生毒力逆转等情况,同样需要在研发过程中予以充分研究。在确保有效性的同时,降低抗原含量,对各阶段的残留物质进行严格的质量控制,可有效确保产品的安全性,降低因疫苗接种产生的不良反应。相较于接种单苗,接种联合疫苗产生的不良反应发生率略高,尤其是局部不良反应。值得注意的是,全身不良反应的严重程度取决于联合疫苗中引发不良反应最强的组分,而不是等同于所有原不良反应的叠加。通常来说,联合疫苗所产生的免疫应答会比分别使用单个疫苗时形成的免疫应答略低。在此情况下,疫苗生产企业通常会采取浓缩或者减少剂量的方式确保联合疫苗保持与单个疫苗类似的体积和浓度。在此过程中,需要特别关注疫苗的配比和浓缩工艺,以免对产品的安全性造成影响。在DTP-Hib 四联疫苗的研究过程中,无论是以全细胞百日咳还是以无细胞百日咳为基础的联合疫苗,接种后均能产生有效抗体,且产生的不良反应均类似其以DTwP 或DTaP 使用的情况,有的甚至比单独使用时还低。类似的情况还有DTP-HepB-Hib 五联疫苗,确保各个组分联合后的安全性也是联合疫苗研发中必须考虑的问题。
如今,各国及地区监管机构非常重视联合疫苗的安全性问题,采取了一系列监测措施并开展了相关研究。在临床研究过程中通常要求扩大样本量,或在本国或地区的特定人群中开展临床试验,观察不良反应的发生频率、严重程度等情况来充分确保疫苗的安全性。在疫苗上市后,通过不良反应监测系统对联合疫苗接种引起的不良反应进行严密监测,以确保其在真实世界中的安全性。
4、小 结
联合疫苗从诞生至今不过短短几十年,但其在疾病预防和控制方面发挥的作用不可小觑。面对随时可能出现的新型疾病和随时变化的流行病学,优化疫苗配方、使用替代佐剂、采用全液体剂型、实现更高程度的联合、具备更好安全性和有效性的联合疫苗研发之路任重道远。随着科学技术水平和创新程度的不断提高,联合疫苗研发必定拥有光明的发展前景,将在免疫规划和疾病防控中扮演更为重要的角色。
引用本文
刘一凡,杨盛然,王佑春*.联合疫苗研发现状及趋势[J].中国食品药品监管,2024(11):4-19.

来源:中国食品药品监管杂志


