您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-21 10:38
内容提要:源自蚕丝的丝素蛋白医用材料在医疗器械领域的应用成为研究热点。丝素蛋白材料主文档备案日益增多,一批丝素蛋白医疗器械获批上市,表现出良好的应用前景。文章介绍了医用丝素蛋白材料在医疗器械中的研究和应用,境内外医疗器械产品上市情况,及丝素蛋白敷料类产品的审评关注点,供行业参考。
关键词:丝素蛋白、医疗器械、医用敷料、医疗器械审评
中国是世界丝绸的发源地,考古证据显示中国的养蚕业早在公元前5000年~公元前3000年的仰韶文化时期便已出现,相关种桑养蚕、缫丝织绸的生产技术在春秋战国时期不断进步,最终经由丝绸之路闻名于世。时至今日,我国提出建设“新丝绸之路经济带”和“21世纪海上丝绸之路”,即“一带一路”的合作倡议,茧丝绸行业也在这一新时代背景下迎来新的挑战和发展机遇。近年来,源自蚕丝的丝素蛋白被制成纤维、膜、粉、微球、海绵、水凝胶、棒材板材等各种形态的生物材料,并在创面修复、组织工程等医疗器械领域研究中展现了良好的性能和前景,为茧丝在生物经济方面的创新和拓展奠定了科学基础。本文旨在介绍医用丝素蛋白材料在医疗器械中的研究和应用及其审评关注点,为相关产业发展提供参考。
一、丝素蛋白材料简介
1.1化学结构
蚕丝由丝素蛋白(约占总蛋白的72%~81%)和丝胶蛋白(约占总蛋白的19%~28%)组成。蚕在吐丝的过程中,丝素蛋白由蚕的后丝腺分泌,形成强韧的纤维,经过前、中丝腺时,丝胶蛋白被分泌并均匀包裹在丝素纤维的表面,丝素蛋白纤维在丝胶蛋白的黏合作用下相互组合,最终形成具有高强度、高柔韧性的蚕丝。核心的丝素蛋白是纤维状蛋白,含18种人体中存在的氨基酸,主要组成为甘氨酸、丙氨酸和丝氨酸。丝素蛋白的分子链构象包括无规卷曲、β-折叠、α-螺旋等[1]。
1.2制备与加工
蚕丝经过脱胶去除表面黏附的丝胶蛋白,留下核心部分为天然丝素蛋白纤维。脱胶方法通常有碱性试剂法、酸性试剂法、酶法等,不同的脱胶方法获得的丝素蛋白存在理化性质的差异,其中碱性试剂法应用较为广泛。天然丝素蛋白经溶解除盐后获得的蛋白质混合物为再生丝素蛋白,其基本的氨基酸序列与天然丝素蛋白相同,分子量、分子链的构效关系发生变化。再生丝素蛋白溶液可经干燥、助剂改性、静电纺丝等步骤,进一步制备成各种不同性状的材料,如纤维、海绵、粉末、凝胶、微球、薄膜等。由于丝素蛋白中存在多种活性氨基酸,可通过各种化学修饰手段赋予丝素蛋白材料各种新的功能和特性,为丝素蛋白材料在各个医疗领域的应用奠定了基础[2]。
1.3生物相容性
蚕丝是蚕分泌到体外的天然高纯度蛋白质,丝素蛋白易从蚕丝中提纯,具有明确的一级结构和氨基酸排序,生物安全性和生物相容性相对较好。丝素蛋白生物材料的生物相容性与脱胶加工技术、再生方式、化学改性、纯化过程等有较大关联。丝素蛋白的最终降解产物氨基酸可被人体吸收,丝素蛋白材料的分子量大小可通过加工处理方式来调节,从而达到适应不同生物体内环境的要求[3]。
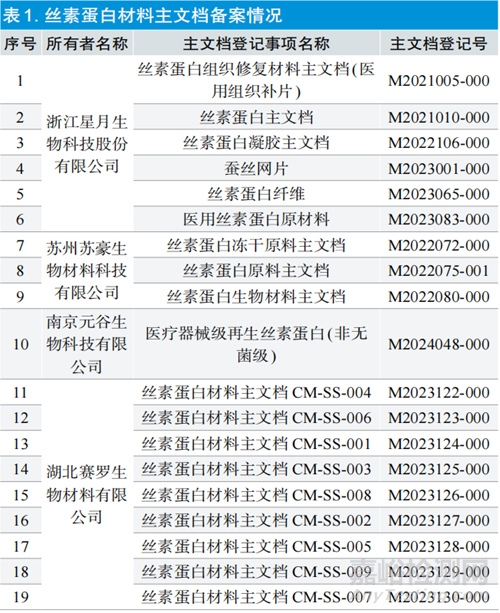
1.4材料主文档备案情况
目前,在国家药监局医疗器械技术审评中心备案的丝素蛋白材料主文档达19个,来自4家公司,见表1。备案类型涵盖纤维、凝胶、组织补片、网片、冻干粉等类型,说明基于丝素蛋白材料的医疗器械产品开发日益活跃。原材料行业标准《组织工程医疗器械 丝素蛋白》于2022年列入制定计划,目前处于报批发布阶段,标准的发布也将进一步规范和促进产业发展。
二、丝素蛋白医疗器械的研究现状
2.1生物补片
张冲[4]将丝素蛋白材料用于制作补片修复肩袖损伤。丝素蛋白生物补片提高了愈合重建后的最大载荷值、刚度和位移生物力学指标,加快了腱-骨界面的愈合以及重建。丝素蛋白生物补片加强了术后腱-骨界面的有序地致密连接,对恢复生理功能起到了一定的促进作用,有望成为修复肩袖撕裂的良好载体。
2.2组织工程支架
王波等[5]概述了丝素蛋白基组织工程支架材料的研究情况,包括骨、肌腱、血管、神经、皮肤等。丝素蛋白/羟基磷灰石复合支架经试验验证了在大鼠颅骨骨缺损修复的促进作用;丝素蛋白血管支架材料通过接枝各种抗凝血剂来调控血管再生微环境,为组织再生提供空间并促进血管的再生;借助静电纺丝、编织和涂层技术制备的复合型丝素蛋白导管,可用于促进大鼠坐骨神经再生。
2.3口腔科材料
赵翔等[6]研究了丝素蛋白支架在颅颌面组织修复中的应用,丝素蛋白具备可调节的机械强度和降解性,具备负载细胞、生物活性因子及药物的载体性能,可满足在颅颌面不同组织部位的性能需求。郑雨欣等[7]概述了丝素蛋白作为口腔组织再生屏障材料的应用,将丝素蛋白与其他材料如氧化锌、羟基磷灰石混合,以及应用静电纺丝的方法使丝素蛋白膜具有良好的力学性能和适宜的降解率,从而更适合于临床应用。
2.4止血材料
雷彩虹等[8]研究了丝素蛋白材料的止血性能。通过凝血因子实验、血小板黏附实验等分析了丝素蛋白材料的止血机制和过程,通过大鼠肝部出血实验评价丝素蛋白材料的止血效果,出血时间、出血量优于市售对照品。
2.5组织黏合剂
汪张伟等[9]将丝素蛋白材料用于制作骨科伤口的医用黏合剂,采用猪皮模拟试验显示搭载的拉伸强度可满足临床需求。丝素蛋白黏合剂具备一定的可降解性能,细胞存活试验和细胞迁移试验显示可对伤口愈合产生积极作用。
三、丝素蛋白医疗器械的上市情况
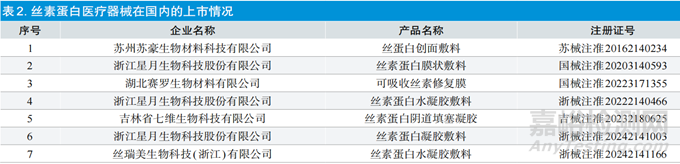
3.1国内批准情况
丝素蛋白材料在医疗器械领域的基础和应用研究较多,但获批上市的产品相对尚少。目前,国内已批准基于丝素蛋白的主要医疗器械产品见表2,除蚕丝缝合线外,已上市丝素蛋白产品以膜状敷料、凝胶敷料为主,二类产品多用于非慢性创面的覆盖和护理,三类产品有用于供皮区覆盖。其中申请激光术后创面护理的产品,是目前医疗美容领域的热点。
3.2境外批准情况
美国 Sofregen Medical,Inc. 开发的 SERI®Surgical Scaffold(510K编号:K123128)和SERI®Contour(510K编号:K172545),由纯丝素蛋白制作,用作软组织支撑和修复的支架,包括在整形和重建手术中加固软组织,以及常规的软组织重建;此外该公司开发了Silk Voice®(510K编号:K180631),是一种可注射的软组织填充剂,主要用于改善声带功能不全。境外批准用于组织工程的丝素蛋白器械产品早于国内。
四、丝素蛋白敷料的审评关注点
目前国内批准上市的丝素蛋白医疗器械以敷料为主,基于作者所在单位的技术审评经验,该类产品有如下审评关注点。
4.1产品技术要求
考虑到原材料的特殊性,产品性能应包括丝素蛋白的鉴别、蛋白质含量。关注丝素蛋白再生过程中引入的加工助剂残留,常见的有溴化锂,视情况制定相应锂元素的残留限制。对于膜状敷料,可参考YY/T 0471系列标准制定液体吸收、水蒸气透过、阻水、阻菌性等适用指标。凝胶类产品应给出黏度参数。
4.2生物安全性
根据《动物源性医疗器械注册技术审查指导原则(2017年修订版)》,由动物组织的衍生物或天然获取的物质(如壳聚糖、蚕丝、蜂蜡等)制成的医疗器械,也需参照该指导原则[10]。因此,申请丝素蛋白医疗器械注册,应按照指导原则和YY/T 0771系列标准提交生物源材料的安全性研究资料,说明生产过程中灭活和去除病毒和/或传染性因子的工艺过程,说明降低免疫原性物质的方法和/或工艺过程,提供验证性实验数据或相关资料[11]。
4.3生物相容性
应按GB/T 16886系列标准对丝素蛋白敷料进行生物学评价,结果应表明无不可接受的生物学危害。生物学评价终点的选择应考虑产品与人体累积接触的最长时间,而不是单次使用接触的时间,目前接触创面的敷料的评价终点至少应包括细胞毒性、致敏反应、刺激或皮内反应、致热性、急性全身毒性。对于液体、凝胶类敷料,常见使用不同的包装方式和包装材料,生物学评价应涵盖不同的初包装材料。
4.4临床评价
符合《免于临床评价医疗器械目录》描述的二类创面敷料大都免于临床评价,对于丝素蛋白敷料,如果申报的结构组成和适用范围在目录的描述范围内,且与已上市同类产品具有等同性,可免于临床评价。如果申报特殊的适用范围,或产品组成与已上市产品存在重大差异,则不排除需开展临床评价或临床试验。
五、小结
丝素蛋白材料具有良好的生物安全性、生物相容性、可设计性、机械和加工性能,已成为新型的平台型材料,有望在各类无源医疗器械产品中得到广泛的应用。目前,除部分丝素蛋白敷料类产品已在国内获批上市外,多数产品仍在临床研究过程中。《组织工程医疗器械 丝素蛋白》标准的立项和发布,将有力规范和促进丝素蛋白相关器械产业发展。作为新材料、新工艺的丝素蛋白敷料产品,申报者和审评人员经验不足也是目前面临的主要问题和制约因素,本文提出的审评关注点可以指导丝素蛋白敷料类产品的生产、研发、审评工作,提高注册申报质量,对相关器械产业的发展有一定促进作用。

来源:中国医疗器械信息


