您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-23 08:37
No.1 文件结构
中国是国际医疗器械监管机构论坛(IMDRF)的主要成员国。
自2019年开始,国家药监局已采用IMDRF的eRPS注册申报资料结构,即医疗器械电子文件结构(Table of Content,检查ToC)。
目前为止,大部分的地方省局也同时采用了eRPS申报方式。
文件结构包括:
第1章 地区性监管信息
第2章 申报产品综述资料
第3章 非临床研究资料
第4章 临床研究资料
第5章 说明书和标签样稿
第6A章 质量管理体系程序
第6B章 产品的质量管理体系相关信息
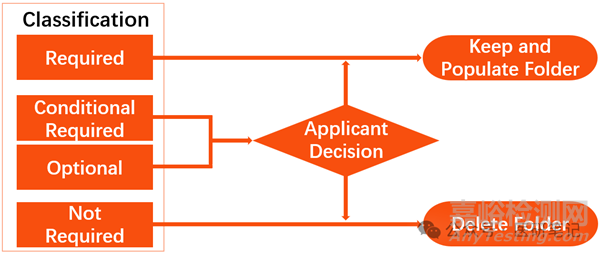
No.2 R, NR和CR
IMDRF编制的注册申报指南,无法适合每个国家,鉴于指南的兼容性,申报资料里的内容,可分为三种情形:
R:必须提交(Required),强制上传
CR:适用时提交(Conditional Required),适用情况下需要提交
NR:不需提交(Not Required),不需提交
No.3 文件格式
所有的文件格式都应该是PDF。
技术要求和说明书还需要提交word版,但要保证与PDF内容一致。
PDF文件尽可能使用由源文件(如WORD文件)转化形成,而不是扫描后创建的PDF。
有些文件,如第三方对的检测报告,其已经含电子签名,无法直接上传,可直接扫描转化再创建PDF,或者将PDF转成jpg格式,再创建PDF。
单个电子注册申报PDF文件在100MB以内。对于大于100MB的文件或申报人认为有必要进行适当拆分时,应将其按照内容进行拆分,并通过文件名称来反映原文件被拆分,如文件标题-part1、文件标题-part2等。
No.4 版面要求
中文字体为宋体,英文字体为Times New Roman。
中文正文字号不小于四号字,表格文字不小于五号字。
申报资料封面加粗三号字。
申报资料目录建议使用四号字,脚注五号字。
行间距离设为单倍。
如页面设置为纵向,左边距离不小于2.5cm、上边距离不小于2cm、其他边距不小于1cm;
如页面设置为横向,上边距离不小于2.5cm、右边距离不小于2cm、其他边距不小于1cm。
No.5 文件命名的要求
文件名称不超过64个字符(32个汉字),文件命名应符合Windows文件命名规则。
同一套电子注册申报资料中的PDF文件不可重名。
No.6 页面和书签
每个PDF文件均应设置页码。
页码建议体现所在目录编号信息,应清晰可辨,建议在文件下方正中位置。
对于页数大于或等于10页的文件,需要设置内部的目录,文件内部目录由书签自动生成,章节、小节、表格、图片和附录均建议作为书签。
No.7 超链接
为保证文件定位的方便快捷,同一份PDF文件内的超链接是允许的,但不应在不同文件之间使用超链接。
PDF文件中如有超链接,确保超链接在预览模式下有效。
参考文献
[1].关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(NMPA, 2021年第121号)
[2].关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(NMPA, 2021年第122号)
[3].国家药监局关于实施医疗器械注册电子申报的公告(NMPA, 2019年第46号)
[4].国家药监局关于医疗器械电子申报有关资料要求的通告(NMPA, 2019年第41号)
[5].关于发布医疗器械注册申请电子提交技术指南的通告(NMPA, 2019年第29号)
[6].关于发布医疗器械注册电子申报目录文件夹结构的通告(CMDE, 2021年第15号)
[7]. Assembly and Technical Guide for IMDRF Table of Contents Submissions, IMDRF/RPS WG/N27 FINAL:2019
[8]. Non-In Vitro Diagnostic Device Regulatory Submission Table of Contents (nIVD ToC), IMDRF/RPS WG/N9 FINAL:2024 (Edition 4)
[9]. In Vitro Diagnostic Device Regulatory Submission Tableof Contents (IVD ToC), IMDRF/RPS WG/N13 FINAL:2023 (Edition 4)

来源:医研笔记


