您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2025-01-02 08:41
数字医疗技术的快速发展改变了全球医疗保健,而软件即医疗器械(SaMD)则成为一项重要的创新。无论是管理慢性疾病、提高诊断准确性,还是实现远程患者监测,SaMD 都重新定义了医疗成果。在印度,中央药品标准控制组织(Central Drugs Standard Control Organization,CDSCO)对 SaMD 的监管已日趋成熟,并与ISO 13485、IEC 62304 和 IMDRF 建议等国际标准保持一致。
如果您是制造商、开发商或质量专业人员,了解 SaMD 的分类、合规性和审批途径对于确保创新和患者安全至关重要。
在印度将软件定义为医疗器械(SaMD)
CDSCO 通过其 2020 年 2 月 11 日的通知 S.O. 648(E),扩大了Drugs and Cosmetics Act中医疗器械的定义,将用于以下目的的软件包括在内:
诊断、预防、监测、治疗或缓解疾病
支持或维持生命
提供生理过程辅助
医疗器械消毒
控制受孕
根据该通知,符合上述任何标准的软件均作为医疗器械进行监管,必须遵守相关法规。
印度 SaMD 监管框架
印度 SaMD 的监管要求符合国际公认的质量、安全和风险标准。SaMD 制造商必须遵守:Medical Device Rules (MDR), 2017
ISO 13485:2016 - Quality Management Systems for Medical Devices
ISO 14971:2019 - Application of Risk Management to Medical Devices
IEC 62304 - Software Lifecycle Processes
IEC 81001-5-1 - Cybersecurity Requirements
IEC 82304-1 - Health Software Standards
这些标准可确保生命周期管理、风险缓解和网络安全,这对 SaMD 的开发和合规性至关重要。
基于风险的 SaMD 分类
印度遵循 IMDRF 基于风险的 SaMD 分类模式,该模式在 CDSCO 2021 年 9 月的指导方针中有所概述:
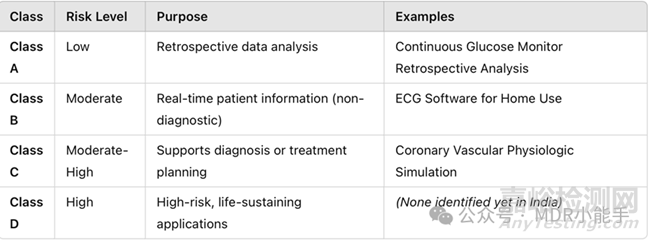
SaMD 制造商必须对其软件进行适当分类,并根据相应的类别风险调整其注册途径和合规要求。
已通报的 SaMD 器械示例
CDSCO 已正式通告了多个不同风险等级的 SaMD 器械:
A 类:连续式葡萄糖监测仪回顾性数据分析软件
B 类:血压计分析软件
C类:冠状动脉血管生理模拟软件
网络安全为何对 SaMD 至关重要
SaMD 依靠数据驱动的算法和基于云的平台,因此数据隐私和网络安全至关重要。遵守 IEC 81001-5-1 等标准可确保防止以下情况的发生:
数据泄露
未经授权的访问
软件漏洞
提示:纳入网络安全测试和上市后监控,以保持合规性并建立用户信任。
印度对软件即医疗器械(SaMD)的监管正在按照全球标准不断发展,以支持医疗保健行业的数字化转型。CDSCO 基于风险进行分类,同时遵守国际准则(ISO、IEC),确保 SaMD 设备安全、有效、可靠。
随着医疗保健专业人员越来越依赖 SaMD 进行关键决策,印度的监管框架在创新与患者安全之间取得了平衡。制造商必须保持积极主动,使其软件开发实践与这些法规保持一致,以成功开拓印度市场。

来源:MDR小能手


