您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-03-27 09:29
不论是国内注册,还是CE或FDA注册,明确产品分类永远是开展医疗器械注册工作的第一步。众所周知,欧盟新法规MDR即将在明年五月底强制执行,那么与旧版MDD相比,新法规在分类规则上存在哪些变化呢?小编今天就和大家聊聊其中的差异。
MDR和MDD分类规则的基本差异
既然是基本差异,那自然要从宽泛或者整体的角度进行比较,比如章节位置、页数、结构、分类规则以及条款数。通过下表的比较,大家可以直观地看到,MDR对于产品分类增加了很多内容,为更多的产品明确了分类界定。
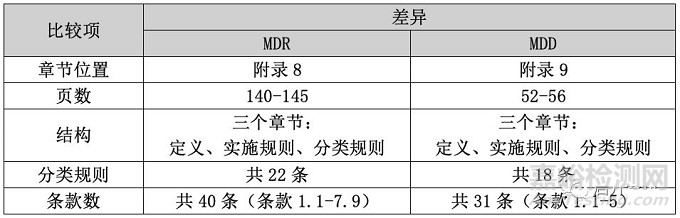
那么为什么会发生这么大变化呢?其实原因很简单,MDD是1993年颁布的指令,与MDR的颁布时间差了近24年,期间医疗器械行业涌现了很多新技术、新材料和新产品,其变化是巨大的。所以,欧盟当然需要通过新的分类规则,以实现更好的监管。那么,从整体上把握了二者的差异后,接下来我们再通过比较三个章节(定义、实施规则和分类规则)的内容,挖掘其中的具体差异。
定义的具体差异
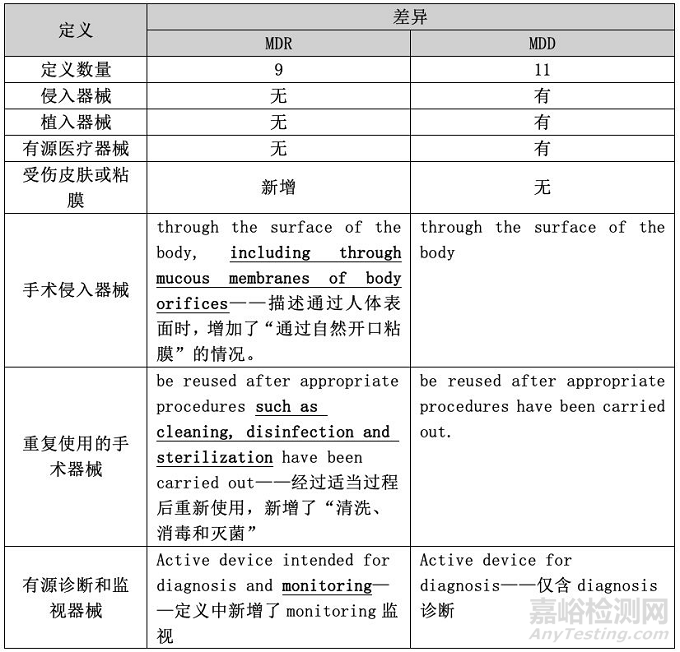
在定义部分,MDD通过8个条款,对持续时间、侵入器械(包括人体自然开口、手术侵入器械、植入器械)、重复使用的手术器械、有源医疗器械、有源治疗器械、有源诊断器械、中央循环系统、中央神经系统这11个定义做了详细说明。
相比之下,MDR在该部分分为两个小节:持续时间以及侵入和有源器械,包括11个条款;明确了持续时间、人体自然开口、手术侵入器械、可重复使用的手术器械、有源治疗器械、有源诊断和监视器械、中央循环系统、中央神经系统和受伤皮肤或粘膜这9个定义。关于MDR和MDD在定义中的细微差异,小编将其整理成了表格,请见下表:
实施规则的具体差异
在实施规则部分,MDR和MDD有很多一致的地方,比如:分类规则应由产品的预期用途决定;驱动或影响器械使用的软件应和该器械分为同一类;如果根据器械的预期用途,多条规则或同一条规则内的多条子规则适用于同一器械,则按最严格的规则或子规则进行更高的分类。但是,MDR也新增了很多实施情况,具体差异请参考下表:

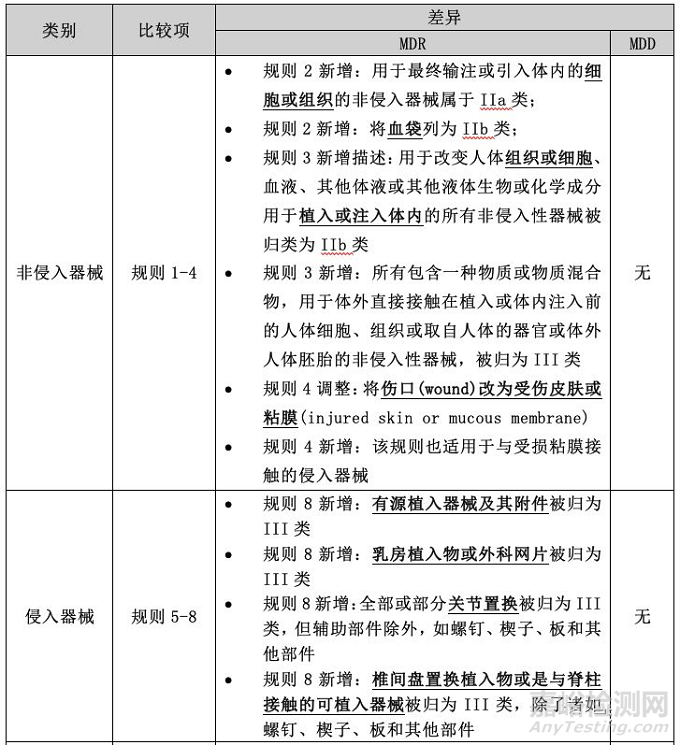
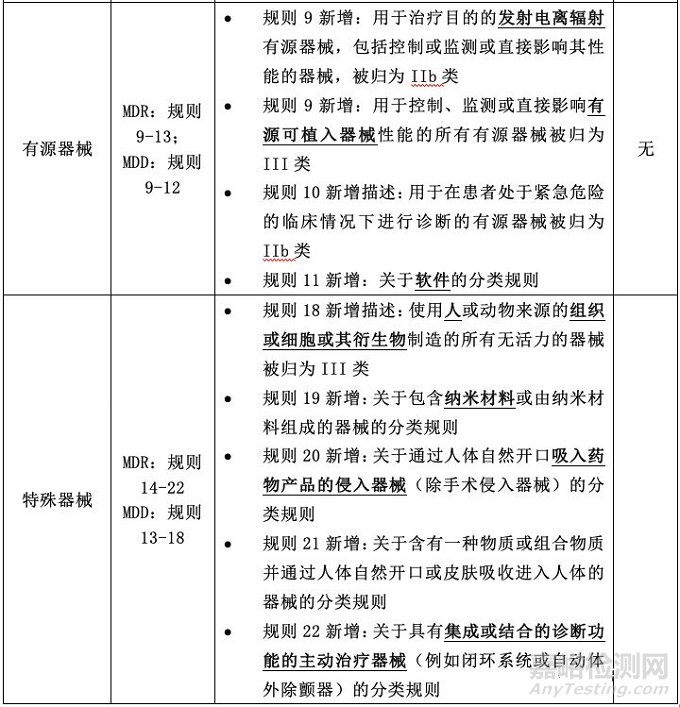
分类规则的具体差异
总体而言,与MDD相比,MDR的分类规则更细,考虑的情况更多,涵盖的产品范围更广。接下来,小编就按产品类别,从非侵入器械、侵入器械、有源器械和特殊器械四部分讨论其中的具体差异。
总结
通过表格对比的形式,小编对MDR和MDD分类规则的差异做了简单梳理,希望给计划或正在开展CE MDR申请的小伙伴们带来一些收获。关于产品分类,小编认为万变不离其宗,明确产品的预期用途一定是第一步,然后大家再仔细比对附录8,找到对应的分类规则,确定产品类别。
参考资料:
1. DIRECTIVE 93/42/EEC
2. REGULATION (EU) 2017/745

来源:启升资讯


