您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-10 09:17
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
普洛药业盐酸安非他酮缓释片获FDA批准。普洛药业旗下巨泰药业与Tulex公司合作开发的仿制药盐酸安非他酮缓释片(300mg)获FDA批准上市。盐酸安非他酮缓释片适用于治疗中重度抑郁症以及季节性情感障碍。该药原研药由VALEANT研发,于2003年8月在美国上市。目前,盐酸安非他酮缓释片在美国的主要生产厂商有PAR,TEVA等;国内目前未有该剂型的产品上市。2018年该产品300mg剂型美国仿制药市场销售额约为1.2亿美元。
国内药讯
1.泛谷药业奥氮平片通过一致性评价。由印度瑞迪博士(Dr.Reddy`s)实验室生产、泛谷药业总经销的奥氮平片(奥兰之)(5mg,10mg)通过一致性评价。此前,奥氮平片已经有豪森药业(5mg,10mg)和齐鲁制药(5mg,10mg)两家企业通过一致性评价。奥氮平是首个获批用于精神分裂症长期治疗的非典型抗精神病药物,也是第一个获批用于治疗急性双相躁狂症的非典型抗精神病药物,原研厂家为礼来,1996年9月获FDA批准上市,目前已获批进口中国。2017年度该品种国内销售额约人民币27亿元。
2.大鹏制药抗代谢复方药物Lonsurf在华获批。大鹏制药新型口服抗代谢复方药物Lonsurf(trifluridine/tipiracil,TAS-102)获国家药监局批准,用于治疗先前已接受过氟尿嘧啶、奥沙利铂或伊立替康为基础的化疗、以及可能接受过或无法接受抗VEGF制剂和(RAS野生型)抗EGFR制剂的转移性结直肠癌(mCRC)患者。一项III期临床TERRA结果显示,研究达主要终点:与安慰剂组相比,TAS-102治疗组死亡风险显著降低21%(HR=0.79,95%CI:0.62-0.99,对数秩p=0.035)、中位总生存期(OS)显著延长(中位OS:7.8个月[95%CI:7.1-8.8] vs 7.1个月[95%CI:5.9-8.2])。
3.复宏汉霖抗EGFR单抗Ⅰa期临床数据即将发布。在第22届全国临床肿瘤学大会暨2019年CSCO学术年会上,复宏汉霖首个自主研发的改良型全人源化重组抗EGFR单抗注射液HLX07治疗晚期实体瘤患者的Ⅰa期临床数据即将以壁报展示的形式发布。基于抗EGFR单抗与抗PD-1单抗可能存在协同作用,复宏汉霖目前也在探索HLX07与HLX10(重组抗PD-1人源化单克隆抗体注射液)联合应用于头颈部鳞状细胞癌的潜在疗效。
4.康宁杰瑞双特异性抗体KN046Ⅱ期临床首例患者给药。康宁杰瑞双特异性抗体KN046治疗非小细胞肺癌的Ⅱ期临床首例患者给药。该研究旨在50例晚期非小细胞肺癌患者中评估KN046联合化疗一线治疗的安全性和疗效。KN046是康宁杰瑞自主研发的全球首创重组人源化PD-L1/CTLA-4双特异性抗体,在澳大利亚和中国同步开展的Ⅰ期临床已初步验证了KN046具备较好的安全性和有效性。目前该药即将完成中国的Ⅰ期临床剂量递增研究,并启动了针对TNBC、ESCC及NSCLC的多项Ⅱ期临床试验。
5.舒泰神注资复宏汉霖IPO。舒泰神子公司舒泰神投资拟以自有资金1000万美元以基石投资者的身份参与认购复宏汉霖在港交所的首次公开发行股份(IPO)。复宏汉霖为复星医药的全资子公司。复宏汉霖研制的利妥昔单抗注射液(汉利康)是国内首个以原研利妥昔单抗为参照药、按照生物类似药途径研发和申报并获批的产品,该药用于非霍奇金淋巴瘤的治疗。汉利康于上半年才开始商业化销售,除汉利康之外,复宏汉霖尚未有其他产品获得监管机构的商业化销售批准。据悉,复宏汉霖本次上市拟集资5亿美元(约39亿港元)。
国际药讯
1.诺华眼科药物Lucentis在欧盟获批第7个适应症。诺华(Novartis)抗VEGF疗法Lucentis(ranibizumab,雷珠单抗)第7个适应症获欧盟委员会批准,用于治疗早产儿视网膜病变(ROP)。该药(0.2mg剂量)将适用于早产儿I区(1+、2+、3或3+期)、II区(1+、2+、3或3+期)、AP-ROP(急进性后部型ROP)的治疗。一项III期研究RAINBOW(NCT02375971)数据显示,用于治疗ROP婴儿时,Lucentis是一种有效安全、耐受性良好的药物。虽然该研究在主要终点方面略微错过统计学上的显著性(p=0.0254,注:p=0.025具有显著性差异),但Lucentis(0.2mg和0.1mg)治疗组与激光手术组在治疗成功率上的差异(分别为80%、75%、66.2%)具有临床意义。
2.Keytruda两项研究与TMB未取得显著关联结果。在第20届世界肺癌大会(WCLC 2019)上,默沙东(MSD)公布免疫疗法Keytruda(pembrolizumab)在2项研究中的疗效与肿瘤突变负担(TMB,免疫疗法的生物标志物)没有显著关联。在Ⅲ期临床KEYNOTE 189中,先前的结果表明,与安慰剂+化疗相比,Keytruda组合疗法显著增加总生存期(OS)、无进展生存期(PFS)、以及客观缓解率(ORR)。但对患者的肿瘤进行全外显子测序时,分析结果显示,TMB与OS、PFS以及ORR没有显著关联。在另一项Ⅱ期临床KEYNOTE 021中,也观察到类似的结果。而且,TMB也与PD-L1的表达量没有显著关联。
3.安进公布KRAS抑制剂最新数据。安进在WCLC 2019会议上公布其KRAS抑制剂AMG 510Ⅰ期临床最新数据。该研究在接受过至少2种疗法治疗的KRAS G12C突变实体瘤患者中开展。数据显示,在接受治疗的34例非小细胞肺癌(NSCLC)患者中,23例可评估疗效,其中11例(48%)获得部分缓解、11例(48%)疾病稳定、1例病情进展(4%),即ORR为48%、DCR为96%;在13例接受最高剂量960mg治疗的可评估患者中,有7例(54%)获部分缓解、6例(46%)疾病稳定,即ORR为54%、DCR为100%;没有观察到剂量限制性毒性,也无导致停药的不良事件,有27例患者仍在治疗。
4.安斯泰来非激素更年期新药进入III期临床。安斯泰来神经激肽-3受体(NK3R)拮抗剂fezolinetant用于绝经后女性治疗中重度血管舒缩症状(VMS,如更年期相关的潮热和盗汗)关键性III期临床SKYLIGHT 1首例患者给药。一项IIb期结果显示,与安慰剂相比,fezolinetant显著降低VMS的发生频率,第12周时与基线比较,每日两次(BID)剂量组VMS发生频率降低74.3%-86.9%,每日一次(QD)剂量组降低75.1%-77.9%,安慰剂组降低55%;fezolinetant有效缓解VMS严重程度,第12周时,BID组和QD组VMS严重程度平均每日变化为-0.3至-0.6、-0.2至-0.5;不良事件发生率在各组间相似,大多为轻中度。
5.住友制药拟收购Roivant公司 5家子公司。住友制药与Roivant Science公司达成新的战略联盟。住友制药拟支付30亿美元的预付款,收购Roivant公司旗下5家子公司的所有股权,并获该公司10% 的股份,以及收购另外6家企业的选择权。交易预计将于10月底正式达成。通过联盟,住友制药将拥有Roivant在Myovant Sciences (女性健康和前列腺癌)、Urovant Sciences (泌尿系统疾病)、Enzyvant Therapeutics (儿童罕见疾病)、Altavant Sciences (呼吸系统罕见疾病) ,以及另外一家尚未公布公司的所有权。交易涉及25种创新临床项目,这些药物有望在2020年到2022年间获批上市。
6.诺华与IFM合作开发新型免疫疗法。致力于开发靶向先天免疫系统的创新疗法的IFM公司子公司IFM Due与诺华达成协议。双方将协同开发抑制cGAS/STING信号通路的一系列创新免疫疗法,治疗多种严重炎症和自身免疫疾病。目前IFM Due公司正在开发口服STING小分子拮抗剂(阻止STING刺激过量干扰素和其他促炎性细胞因子产生), 临床试验预计2021年开展。另一个开发项目是cGAS的小分子抑制剂。根据协议,诺华将为IFM Due公司的cGAS/STING研发项目提供资金支持,以换取收购该公司的选择权。在行使权力时,IFM Due公司的股东将有权获高达8.4亿美元的付款。
医药热点
1.仁济医院:《CRISPR技术助力智能核酸水凝胶》发表。上海交通大学医学院分子医学研究院院长、中科院院士谭蔚泓受邀在《科学》(Science, IF=41.037)在线发表《CRISPR技术助力智能核酸水凝胶》,介绍最新利用CRISPR基因编辑技术构建智能水凝胶体系的进展,该体系可用作便携,快速和定量的生物传感器,用于检测危险病毒病原体的特定菌株,区分病原菌、人类DNA的基因型等,由此可应用于病毒检测、细胞培养、电路控制、信号传递等多个领域中。此次研究极大地拓展了智能DNA水凝胶的应用范围,同时也标志着CRISPR基因编辑技术进军材料领域。
2.第五批过度重复药品目录公布。中国药学会官网发布第五批过度重复药品目录,共计303个药品上榜。此次目录包含的303个通用名品种,占全部化药及生物制品通用名总数的10.39%,其涉及的有效批文数占化药及生物制品制剂批文总数的68.09%。与第四批目录相比,本次目录调入7个通用名品种,分别为阿德福韦酯、吡罗昔康、复方氨酚那敏、酮洛芬、氯芬黄敏、胃膜素、颠茄磺苄啶,调出了维生素E烟酸酯1个通用名品种。目录不含相关通用名品种项下的特殊剂型、质量标准或质量有较大提升的品种、临床短缺品种及儿童药。
3.首个“人类猴子嵌合体”研究已中止。据相关外媒报道,美国加州索尔克研究所的西班牙裔科学家Juan Carlos Izpisua Belmonte团队构建出含有人类和猴子细胞的胚胎,为了避免法律问题,这个有争议的项目是在中国进行的。该研究旨在培育出能够长出人体器官的嵌合体,即通过注入人类干细胞等技术,使得在猴子胚胎中发育人体器官。此次研究除了Juan Carlos Izpisua Belmonte的团队和来自西班牙穆尔西亚天主教大学的科学家参与,有报道称,还有中国研究人员的参与。据悉,迫于伦理和舆论的压力,该团队在胚胎发育第14天时销毁了胚胎。
【易名医药】全资子公司四川维奥制药有限公司获产品“多潘立酮片”的《药品补充申请批件》,属全国第一家通过该品种仿制药质量和疗效一致性评价的企业。
审评动向
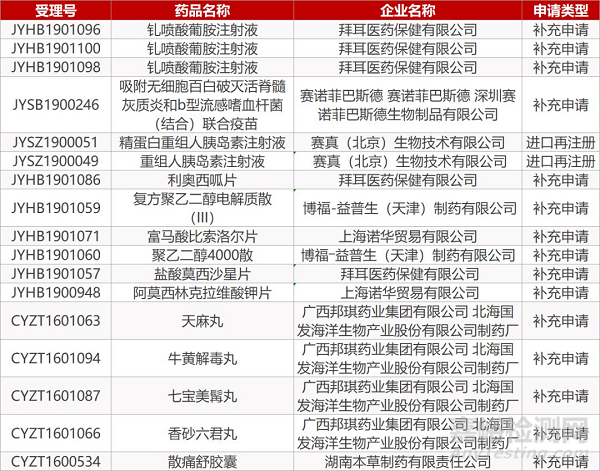
1. CDE最新受理情况(09月09日)
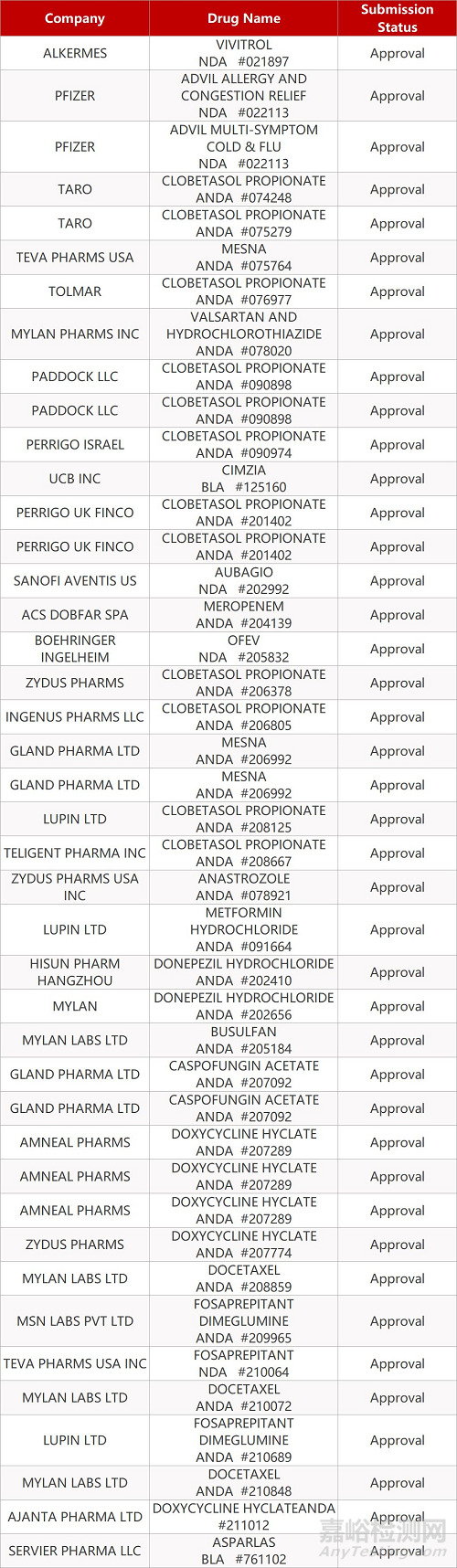
2. FDA最新获批情况(北美09月08日)

来源:药研发


