您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-03-23 15:40
1.什么是标准?
GB/T20000.1-2014《标准化工作指南 第一部分:标准化和相关活动的通用词汇》中对标准的定义:通过标准化活动,按照规定的程序经协商一致制定,为各种活动或其结果提供规则、指南或特性,供共同使用和重复使用的文件。
注1:标准宜以科学、技术和经验的综合成果为基础,以促进最佳的共同效益为目的。
注2:规定的程序指制定标准的机构颁布的标准制定程序。
注3:诸如国际标准、区域标准、国家标准等,由于它们可以公开获得以及必要时通过修正或修订保持与最新技术水平同步,因此它们被视为构成了公认的技术规则。其他层次上通过的标准,诸如专业协(学)会标准、企业标准等,在地域上可影响几个国家。
2.标准的特点
2.1标准的目的
标准用来调整人与自然规律的关系,标准必须建立在科学技术和经验的综合成果基础上,始终反应新技术状况。
2.2标准的民主性
标准是利益相关方(用户、组织者和监管者)协调一致的产物,这也就注定标准是一个中和各方利益后的协定,并不严苛,行业内领跑的巨头其产品技术要求往往要优于标准许多,有关重要利益相关方对于实质性问题没有坚持反对意见,同时按照程序考虑了有关各方的观点并且协调了所有争议。注:协商一致并不意味着全体一致同意。
2.3标准的权威性
标准必须由一个公认的机构批准,这个公认的机构具有足够的权威。任何国际标准首先要转化成本国或本地区的标准才能用于监管。
2.4标准的可操作性和可重复性
2.5标准内容的广泛性
它要求的是技术性内容。随着管理日益现代化和管理重要性的不断增强,管理标准的种类和数量逐渐增多,而且出现了管理体系标准
2.6标准的格式
标准有特定的制定程序、编写原则和体例格式,以便于理解、执行。国际标准的制定和实施貌似公正,客观上对发展中国家却形成了壁垒。
3.中国标准化现状
中国的标准化工作始于1956年,目前我国2017年新《标准化法》规定,我国标准按规范对象分类,医疗器械标准可以分为基础标准、产品标准、方法标准和管理标准;按标准性质效力/分类,医疗器械标准分为强制性标准和推荐性标准。
国家标准
按照标准性质分为强制性国家标准(GB)、推荐性国家标准(GB/T)行业标准
按照标准性质分为强制性行业标准(YY)、推荐性行业标准(YY/T)
《标准化法》规定分为五级标准:
——国家标准
——行业标准
——地方标准
——团体标准(今后标准化的发展趋势)
——企业标准(已经改为产品技术要求)
国家标准由国务院标准化行政主管部门制定。对没有国家标准而又需要在全国某
个行业范围内统一的技术要求,可以制定行业标准。企业生产的产品没有国家标准和行业标准时,应当制定企业标准,作为组织生产的依据。
4.专业标准化技术(分技术)委员会
目前共设置26个医疗器械专业标准化技术委员会,其中总技委13个,分技委
13个。新增的全国外科植入物和矫形器械标准化技术委员会有源植入物分技术委员会、全国医疗器械生物学评价标准化技术委员会纳米医疗器械生物学评价分技术委员会、医用增材制造技术标准化技术归口单位、医用电声标准化技术归口单位、人工智能医疗器械标准化技术归口单位正在组建中。
26个医疗器械标委会均与国际标准化机构对口,与国际电工委员会(IEC)对口的技委会共有8个,与国际标准化组织(ISO)对口的技委会有18个。
十三五期间加强了专业标准化技术委员会的建设,26个标技委均完成了组建或换届,其组成人员结构得到了改善了提高,秘书处充实了专职人员,得到了挂靠单位领导的重视;医疗器械标准修订规范得到加强,标准起草人的确定、征求意见及不同意见的统一等均按规范执行;加强了医疗器械标准中重要指标的验证工作。
5.中国医疗器械标准的现状
标准项目
截止2018年11月医疗器械标准共有1599项。
国家标准219项-主要是基础性、安全性、通用性标准。(GB 87项、GB/T 130项)
行业标准1380项-产品类标准居多(56%)。(YY 362项、YY/T 1018项)

标准管理办法7项突出修订内容:
1、明确了标准定义和层次、完善标准体系;
在总则中增加了第二条医疗器械标准定义。强化总局在医疗器械标准工作中的管理地位明确了标准的使用范围和作用突出了标准统一、协调的原则。
明确了医疗器械国家标准与行业标准,强制性标准与推荐性标准,医疗器械基础标准、方法标准、管理标准和产品标准的划分原则,体现了医疗器械标准分级、分类的体系建设思路,进一步提高标准体系的整体性和系统性,提升医疗器械标准的总体质量和水平。
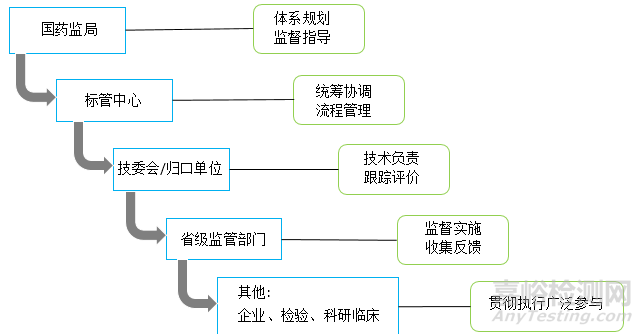
2、理顺了层级关系、落实各方职责;
理顺了参与标准化工作各部门及相关单位等的层级关系,明确了总局、标管中心、技委会、技术归口单位、地方局、相关单位及其他相关方各自承担的标准化职责和工作内容。
增加并明确了“总局医疗器械标准管理中心”的职責对其拟定医疗器械标准规划、组织标准体系研究、标准制修订管理、标委会管理以及标准实施协调等职能进行了细化,有利于充分发挥总局标管中心的作用。
3、加强精细化管理,确保标准质量;
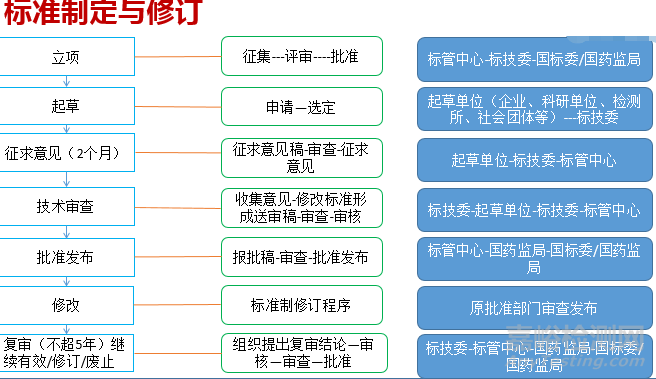
《办法》第三章对标准制修订各环节,包括立项、起草、征求意见、技术审查、批准发布、复审等,均以单独条款进行规定,对各环节的重点内容提出要求,具有更强的指导性和可操作性,为实现医疗器械标准精细化管理莫定了法规基础配套文件《医疗器械标准制修订工作管理规范》的制定提供了上位法依据。
4、强化跟踪评价、实现闭环管理;
进一步强化了标准的跟踪评价及实施评估。《办法》规定了医疗器械标准化技术委员会对标准的实施情况进行跟踪评价,并明确由总局标管中心对其进行统计分析,实现了对医疗器械标准的闭环管理。
5、加大标准公开力度,提高标准可及性;
加大了标准公开力度。《办法》规定了医疗器械国家标准、行业标准按照国家标准化管理委员会相关规定进行公开,供公众查阅,提高了标准可及性。
6、强化标准实施,服务日常监督;
7、强化团体标准推动供给侧改革。

6.有源医疗器械最重要的基础标准
由于有源医疗器械覆盖面及其广泛,基于此,国内推荐GB9706.1、GB/T14710、YY0505、GB17626系列、GB4824等具体产品专标不做推荐。

来源:杨粟宁/医械测试


