您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-21 17:35
一、基本概况
1.自然环境
阿根廷位于南美洲东南部,东濒大西洋,南与南极洲隔海相望,西邻智利,北与玻利维亚、巴拉圭交界,东北与乌拉圭、巴西接壤。南北长3694公里,东西宽1423公里。陆上边界线长25728公里,海岸线长4725公里。北部属热带气候,中部属亚热带气候,南部为温带气候。年平均气温北部24℃,南部5.5℃。
2.人口和行政区划
阿根廷人口为4589万(2022年)。白人和印欧混血种人占95%,白人多属意大利和西班牙后裔。印第安人口95.5万,其中人口最多的少数民族为马普切人(Mapuche)。官方语言为西班牙语。73.9%的居民信奉天主教,6.6%的居民信奉新教(2020年)。
全国划分为24个行政单位。由23个省和联邦首都组成。首都为布宜诺斯艾利斯(Buenos Aires),人口312万(2022年)。
3.2024年出口概况
2024年,中国向阿根廷出口医疗器械总计约14.8亿元人民币,同比减少6.32%。
二、监管机构和法规要求
阿根廷的医疗器械产品注册由卫生部(Ministry of Health)下属的药物、食品医疗技术管理当局Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)负责。阿根廷医疗器械注册需要遵循以下法规要求。
◆ 主要法规:
Resolution 3802/2004:医疗器械监管的法规框架
Disposición 2318/2002:一般医疗器械分类及要求
Disposición 727/2013:医疗器械产品注册要求
Disposición 2198/2022:IVD产品分类及要求
三、医疗器械定义
◆ 医疗器械(Medical Device,MD):用于医疗、牙科或实验室使用或应用的保健产品,如设备、仪器、材料、物品或系统,用于预防、诊断、治疗、康复或避孕,且不使用药理学、免疫学或新陈代谢手段在人体内发挥其主要功能,但可同时使用这些手段辅助其功能。
◆ 体外诊断试剂(In Vitro Diagnostic Medical Device,IVD):制造商旨在单独或组合使用的任何医疗器械,仅用于或主要用于人体样本的体外分析,以提供用于诊断、监测或兼容性目的的信息。
注:用于体外诊断的医疗器械的定义包括试剂、校准品、对照材料、样品收集器、软件、仪器或其他用于以下目的的物品:诊断、诊断辅助、检测、监测、易感性、预后、预测、生理状态的确定。
特殊备注:
IVD定义不适用于:
a)在实验室中普遍使用的物品或仅用于研究目的的物品,除非由于其特性,制造商专门用于体外诊断医疗器械定义中规定的目的之一;
b)侵入性采样产品;
c)国际认证的标准物质;
d)用于外部质量评估计划的材料。
四、产品分类
◆ 分类依据:
MD: Annex II of Disposición 2318/2002
IVD: Annex I of Disposición 2198/2022
◆ 分类:


五、注册流程
1.产品注册流程

2.注册提交技术文件
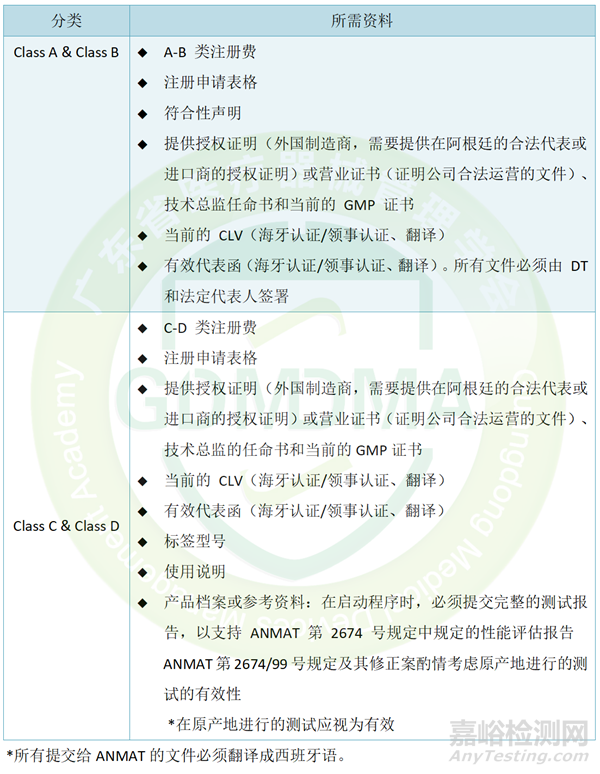
MD产品注册需提交的资料
IVD产品注册需提交的资料
3.注册周期及费用

*注册费和审核时间可能会发生变化,通常由 ANMAT 根据设备的分类和复杂性决定。
4.注册提交流程
使用在线系统HELENA系统提交,由阿根廷当地授权代表(AAR)提交申请。
5.现场审核要求及注意事项
鉴于当前的卫生紧急情况以及在其所代表的国家/地区以外进行检查的困难,ANMAT除了验证位于国外的工厂是否符合良好生产规范 (GMP) 或更新此类证书的请求外,还接受主管机构颁发的符合现行 ISO 13485 标准的证书或 MDSAP 证书,以证明符合工厂要求。
6.该区域有关UDI的要求
阿根廷建议UDI,但其采用的产品监管方式为可追溯性系统,UDI≠可追溯性系统。
医疗产品可追溯性系统由参与在本国家管理局注册的医疗产品分销、分配和应用链的自然人或法人实施,卫生部第 2175/2013 号将在第一阶段适用于以下植入式医疗器械:
a)心脏除颤器/心脏转复器
b)电子耳蜗听力刺激器
c) 人工晶状体
d) 心脏起搏器
e) 内部乳房假体
f) 冠状动脉血管支架
g) 髋关节假体
h) 脊柱假体
1. 以上所涵盖的医疗产品的注册人应根据 GS1 标准的建议,在每个单位的外包装上放置能够存储唯一代码的支架或设备,其中包含以下信息:
a)全球贸易项目编号,GTIN
b)序列号,最多二十个字母数字字符
c)批号
d)到期日(如适用),它必须以 “DD/MM/YY” 格式编码
2. 根据2303/2014规定获得的医疗产品的注册持有人必须在国家医疗产品可追溯性系统数据库中注册,该数据库将由本管理局管理,为此,他们必须通过使用GS1阿根廷组织授予的GLN(全球位置号)代码进行识别。此代码实时报告产品的物流相关信息,并与上述A中的代码相关联:
a)货物接收人代码(GLN/CUFE)
b)日期
c)有关分销业务的发票和送货单
其他注意事项或特别提醒
a) 欧盟或美国监管机构的批准可以加快阿根廷医疗器械注册的审核流程,在大多数情况下,ANMAT接受来自欧盟或美国监管机构提交的文件和数据作为参考。如医疗器械已获得欧盟/美国的批准,则可以通过快速医疗器械注册流程在阿根廷 NAMAT 获得注册批准。
b) 证书的有效期是5年,若证书到期需要续证,应向 ANMAT 提交重新验证请求,最好在到期之日起 90 天内对设备进行重新验证。

来源:广东省医疗器械管理学会


