您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-14 09:52
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
恒瑞PD-L1联合化疗治疗NSCLC III期临床启动。4月10日,恒瑞医药登记启动SHR-1316或安慰剂联合化疗作为可切除非小细胞肺癌(NSCLC)围手术期治疗的随机、双盲、多中心IB/III期临床研究。该研究拟在486例可手术切除的NSCLC患者中评估SHR-1316或安慰剂联合化疗用于新辅助治疗的主要病理学缓解率、无事件生存时间。SHR-1316是恒瑞自主研发的一款PD-L1单抗药物,目前共有3项临床试验正在进行中。
1.芯超生物2019-nCoV抗体检测试剂盒获应急批准。芯超生物新冠病毒(2019-nCoV)抗体检测试剂盒(胶体金法)获国家药监局新冠病毒应急医疗器械审批批准。该试剂盒用于体外定性检测人血清、血浆、静脉全血样本中新型冠状病毒抗体。仅用作对新冠病毒核酸检测阴性疑似病例的补充检测指标或疑似病例诊断中与核酸检测协同使用,不能作为新冠病毒感染的肺炎确诊和排除的依据,不适用于一般人群的筛查。仅限医疗机构使用。
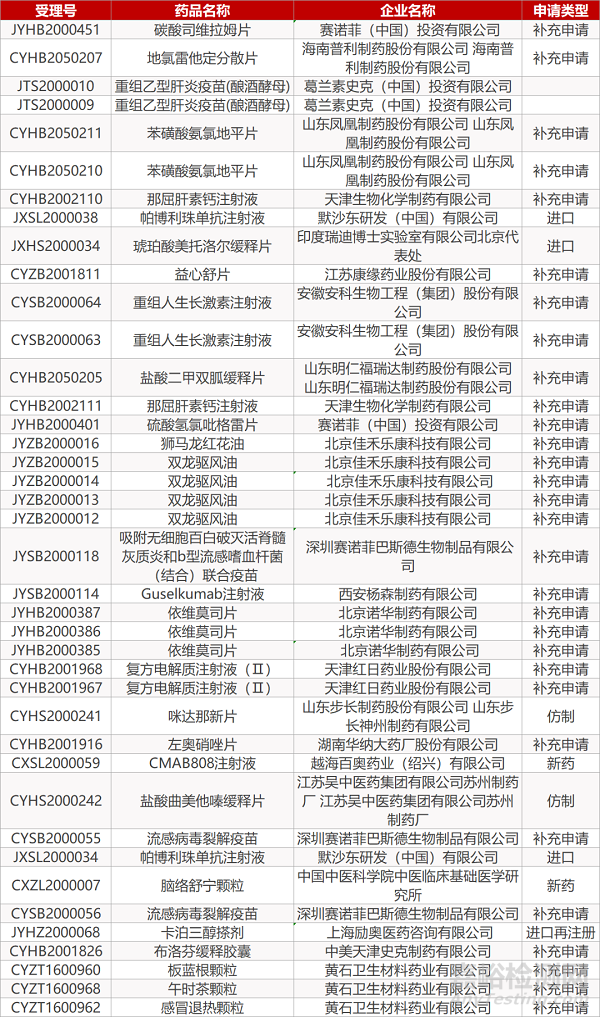
2.景峰医药伊立替康一致性评价申请获受理。景峰医药旗下盐酸伊立替康注射液一致性评价补充申请获国家药监局受理。盐酸伊立替康注射液适用于晚期大肠癌患者的治疗,可与5-氟尿嘧啶和亚叶酸联合治疗既往未接受化疗的晚期大肠癌患者;也可以作为单一用药,治疗经含5-氟尿嘧啶化疗方案治疗失败的患者。根据IMS数据显示,盐酸伊立替康注射液2019年的全球销售额为6.5亿美元,中国销售额为1.4亿美元。
3.汇宇制药奥沙利铂拟纳入优先审评。汇宇制药奥沙利铂注射液获CDE纳入拟优先审评公示名单,纳入理由为“同一生产线生产,已于2020年在欧盟国家上市,申请国内上市”。奥沙利铂是第三代铂类抗肿瘤药,用于转移性结直肠癌的一线治疗以及原发肿瘤完全切除后的III期结肠癌的辅助治疗。2018年中国公立医疗机构终端奥沙利铂销售额为31.44亿元,其中原研厂家赛诺菲占据55.28%的市场份额。目前该品种还没有企业通过一致性评价,汇宇制药以化药新3类报产,若顺利获批将视同通过一致性评价。
4.德琪医药双靶点抑制剂ATG-019首例患者给药。德琪医药合作品种PAK4/NAMPT双靶点抑制剂ATG-019的Ⅰ期临床于中国台湾完成首例患者给药。该试验旨在通过ATG-019单药和ATG-019加以niacin ER(维生素B3/菸碱酸)治疗晚期实体肿瘤或非霍奇金淋巴瘤,以评估其安全性与耐受性。ATG-019是Karyopharm公司开发的一款全新机制全新靶点的口服小分子药物。临床前试验显示,ATG-019对肺癌、多发性骨髓瘤、白血病、淋巴瘤等多个瘤种表现出明显的抑制效应。
5.国药集团旗下COVID-19灭活疫苗即将进入临床。4月13日,国药集团中国生物武汉生物制品研究所有限责任公司研发的新冠病毒(COVID-19)灭活疫苗(Vero细胞)的临床试验申请在中国临床试验注册中心正处于“通过审核”预注册状态,预计这项随机、双盲安慰剂平行对照的Ⅰ/Ⅱ期临床试验将于近期启动。据悉,这是中国第二个注册进入临床试验的新冠病毒疫苗。该研究将评估这款灭活疫苗(Vero细胞)在6岁及以上健康人群中接种的安全性和免疫原性。
6.信立泰特立帕肽注射液临床申请获受理。信立泰特立帕肽注射液临床试验申请获国家药监局受理。特立帕肽是礼来开发的骨质疏松治疗领域的重磅药物,2002年获批于美国上市,商品名复泰奥,2011年获批在国内销售。此前,信立泰该品种的注射用特立帕肽(欣复泰)已获国家药监局批准上市,用于有骨折高发风险的绝经后妇女骨质疏松症的治疗。信立泰特立帕肽注射液可直接皮下注射(无需溶解),为患者提供更多选择。
1.BioMarin软骨发育不全症治疗药物即将申报上市。BioMarin公司宣布将于2020年第三季度向FDA和EMA提交vosoritide(伏索利肽,BMN111)的上市申请。vosoritide是一种C型利钠肽(CNP)类似物,如果获批,vosoritide将成为美国和欧盟首款治疗软骨发育不全症的药物。在一项全球性III期研究中,5-14岁儿童患者治疗一年后,经安慰剂校正,vosoritide治疗的生长速度相对基线的变化为1.6厘米/年(p<0.0001),达主要终点指标。该结果与广大患者群体中的结果一致,且vosoritide的一般耐受性良好,无临床上显著的血压下降。
2.氯喹治疗COVID-19:高剂量组存在安全隐患。巴西科学家在预印本平台medRxiv上公布代号为CloroCovid-19的一项IIb期临床研究(NCT04323527)的初步安全性结果。该试验评估两种剂量的氯喹用于SARS-CoV-2感染继发的严重呼吸综合征住院患者辅助疗法的安全与有效性。与低剂量组相比,高剂量组更多患者(25%)出现QTc>500ms。此外,高剂量组有2例患者在死亡前发生室性心动过速。两组之间的血液学和肾毒性无差异。与低剂量组相比,高剂量组表现出死亡率(17%)更高的趋势。数据安全与监测委员会建议中断高剂量组的研究,停止该组患者的招募,并将已纳入该试验的所有患者调至低剂量组。
3.礼来JAK1/2抑制剂治疗COVID-19进入临床试验。4月10日,礼来与美国国家过敏和传染病研究所(NIAID)达成协议,将为NIAID的COVID-19临床项目提供其已获批用于治疗类风湿性关节炎的JAK1/2抑制剂baricitinib,NIAID本月将在美国启动其评估多种疗法治疗COVID-19患者的临床研究。该研究预计在未来两个月中获得结果。此外,礼来宣布,将启动Ⅱ期临床检验其在研血管生成素2(Ang2)单抗LY3127804治疗急性呼吸窘迫综合征(ARDS)高危患者的疗效。
4.苹果联手谷歌开发接触者追踪技术。苹果和谷歌联合宣布,将共同开发基于蓝牙技术的接触者追踪(contact tracing)技术,帮助公共卫生机构减少新冠病毒的扩散。目前,世界上多个公共卫生机构、大学、和非盈利组织已开发出用户选择加入的技术/软件,帮助进行接触者追踪。两家公司将在5月份发布这些软件供用户下载,然后将开发一个基于蓝牙的更为广泛的接触者追踪平台,并将该平台的功能整合进入操作系统中。它在用户允许参与的情况下,提供强大的追踪功能。
5.Vir公司与三星生物达成一项合作协议。Vir Biotechnology和三星生物签署了一项价值3.62亿美元的合作协议,以扩大Vir单克隆抗体的生产计划,该疗法将有望成为COVID-19的潜在疗法。作为协议的一部分,三星生物预计将在今年10月初进行首次工程设计生产,并有可能在2021年开始在其工厂批量化生产。最终条款预计7月31日前敲定。Vir旗下拥有多款有潜力治疗冠状病毒(包括SARS和MERS)的全人源单克隆抗体,这类抗体是从感染SARS的人体内分离得来的,其中某些单抗很有可能可用于治疗COVID-19。
6.吉利德与Second公司达成战略合作协议。吉利德和专注于微生物组研究的Second Genome公司达成为期4年的合作。Second 将利用其微生物组分析平台为吉利德在研药物鉴定新型生物标志物和筛选优化患者的潜在疗法,以及结合其它的工具来寻求与炎症性肠病(IBD)相关的新靶点和候选药物。双方将在4年内确定多达5个新型IBD靶标或候选药物,并可选择将合作再延长两年。Second 将获3800万美元的前期付款、高达约3亿美元的潜在里程碑付款以及药物的销售额分成。吉利德将拥有5个开发项目在全球范围内的选择权,以及在合作中开发的所有生物标志物的专有权。
1.世卫组织:全球逾2.2万医护人员感染新冠。世卫组织11日发布的疫情报告显示,截至4月8日,52个国家和地区累计向世卫组织报告医护人员新冠感染病例22073例。报告指出,由于缺乏报告医护人员感染情况的系统性机制,相关信息迄今较为有限,全球医护人员感染的实际情况可能更严重。初步研究结果显示,医护人员在医疗场所和社区均出现感染情况,其中多数情况是被家庭成员传染。世卫组织强调,医护人员在临床工作中应正确使用个人防护用品。
2.中国疾控中心实验室检测队驰援绥芬河。4月12日,由中国疾控中心病毒病预防控制所15名专家组成的实验室检测队从北京启程,奔赴黑龙江省绥芬河市,援助当地开展新冠肺炎输入病例防控。至此,中国疾控中心共有22名专家在绥芬河市参与疫情处置。实验室检测队到达后,将搭建起负压帐篷式移动实验室,该实验室拥有独立排风系统,达到生物安全三级实验室的防护要求,将承担实验室筛查和留观等多项工作。绥芬河当地核酸日检测能力有望增加1000份以上。
3.2020年度最具创新力药企:罗氏和阿斯利康位居榜首。IDEA Pharma发布2020年度医药创新指数排行榜,以及2020年度医药发明指数排行榜。在医药创新指数排行榜中,罗氏首次登上榜首;在针对研发管线的医药发明指数排行榜中,阿斯利康保持了行业第一的位置。此外,恒瑞医药首次登上了这两个榜单,在医药创新指数和医药发明指数中分别位居第13名、第15名,这也是本次唯一一家入选的中国企业。
【奥赛康】全资子公司江苏奥赛康及其全资子公司奥赛康生物于近日收到国家药品监督管理局下发的ASKB589注射液新药临床试验申请《受理通知书》,注册分类为治疗用生物制品1类。
【金陵药业】归属于上市公司股东的净利润为-2,103万元至-4,206万元,比上年同期下降110%至120%。归属于上市公司股东的扣除非经常性损益的净利润为661万元至1,322万元,比上年同期下降40%至70%。基本每股收益为亏损0.0417元/股至0.0835元/股。
【博雅生物】公司于2020年4月11日收到中国证监会出具的《关于不予核准博雅生物制药集团股份有限公司发行股份、可转换公司债券购买资产申请的决定》。
- The End -

来源:药研发


