您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-05-09 18:43
椎体成形球囊扩张导管注册技术审查指导原则
本指导原则旨在指导和规范椎体成形球囊扩张导管(以下简称球囊扩张导管)产品的注册申报工作,帮助注册申请人理解和掌握该类产品的原理、结构、主要风险、性能、预期用途等内容,用来指导注册申请人准备和撰写申报资料。同时也可以用于帮助审评人员把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的核心内容是在目前的科技认知水平和现有产品技术基础上形成的。因此,相关人员参考时需注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。随着对产品理解的不断深入,本指导原则相关内容也将适时进行调整。
本指导原则不作为法规强制执行,如有能够满足法规要求的其他方法也可以采用,但需提供详细的研究资料和验证资料。需在遵循相关法规的前提下使用本指导原则。
一、适用范围
本指导原则适用于经皮椎体后凸成形术(Percutaneous Kyphoplasty,PKP)中使用的球囊扩张导管的注册申报。
根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017年第104号),分类编码为04-17-01。管理类别为III类。用于骨折的复位和/或在椎体松质骨内形成可供填充物填充的空腔。该产品只作为手术工具使用,不可用于植入。
本指导原则不适用于植入类型的囊袋以及机械结构的撑开器。
二、技术审查要点
(一)产品名称要求
球囊扩张导管产品的命名需采用《医疗器械分类目录》或国家标准、行业标准中的通用名称,或以产品结构和预期目的为依据命名,需符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关法规的要求。
(二)产品的结构和组成
椎体扩张球囊导管主要由囊体、显影环、导管(由外管和内管组成)、连接件、单向阀/鲁尔接头(若适用)组成;部分球囊扩张导管可包含预置支撑丝,预置支撑丝由螺纹帽和导丝组成(见图1)。
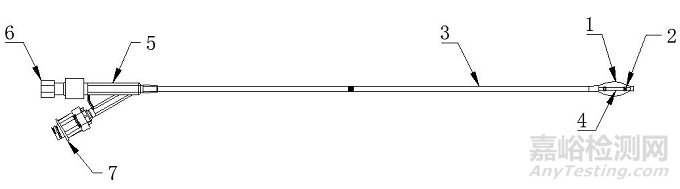
1.囊体 2.显影环 3.外管 4.内管 5.连接件
6.预置支撑丝7. 单向阀/鲁尔接头(若适用)
图1 球囊扩张导管结构示意图
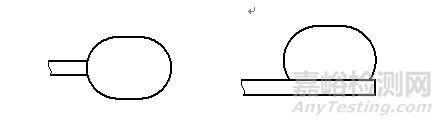
a双侧撑开 b单侧撑开(定向撑开)
图2 球囊撑开后的型式
导管可为不锈钢材料或高分子材料,显影环多为铂铱合金,鲁尔接头、连接件的材料为聚碳酸酯(PC)等高分子材料。球囊的材料可为聚氨酯(PU)等。需明确各组件材料牌号。
(三)产品工作原理
球囊扩张导管通过经皮穿刺建立椎体的工作通道,通过该通道将球囊扩张导管置于椎体内,将球囊充压装置的锁定接头与球囊扩张导管的单向阀/鲁尔接头连接,用球囊充盈装置通过显影剂为球囊进行充压,实现球囊在椎体内逐渐扩张,建立注入骨水泥的空腔。产品为一次性使用,灭菌包装。
(四)注册单元划分的原则和实例
球囊扩张导管可单独申报,也可与为完成同一个手术目的而配合使用的工具组合作为同一注册单元申报。囊体材料不同需划分为不同注册单元。
(五)产品适用的相关标准
产品可参考的相关标准如表1所示。
表1 相关产品标准
|
标准号 |
标准名称 |
|---|---|
|
GB 4234.1-2017 |
《外科植入物金属材料第1部分:锻造不锈钢》 |
|
YY/T 0294.1-2016 |
《外科器械金属材料第1部分:不锈钢》 |
|
GB 18279.1-2015 |
《医疗保健产品灭菌环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求 》 |
|
GB 18280.1-2015 |
《医疗保健产品灭菌辐射第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》 |
|
GB/T 1962.1-2015 |
《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求》 |
|
GB/T 1962.2-2001 |
《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头》 |
|
GB/T 14233.1-2008 |
《医用输液、输血、注射器具检验方法第1部分:化学分析方法》 |
|
GB/T 14233.2-2005 |
《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》 |
|
YY/T 0149-2006 |
《不锈钢医用器械耐腐蚀性能试验方法》 |
|
YY/T 0285.1-2017 |
《血管内导管一次性使用无菌导管第1部分:通用要求》 |
|
YY/T 0285.4-2017 |
《血管内导管一次性使用无菌导管第4部分:球囊扩张导管》 |
|
YY/T 0806-2010 |
《医用输液、输血、注射及其他医疗器械用聚碳酸酯专用料》 |
上述标准包括了产品技术要求中经常涉及到的标准。不包括根据产品的特点所引用的一些行业外标准或其他标准。
(六)产品的适用范围、禁忌症
产品的适用范围需与申报产品的性能、功能相符,并与临床评价资料结论一致。
适用范围:
用于经皮椎体后凸成形术,通过球囊扩张建立骨水泥注入空腔。该产品只作为手术工具使用,不可用于植入。
相对禁忌症可包括:1.与椎体压缩骨折无关的神经压迫引起的根性痛;2.脊柱骨折或肿瘤进入硬膜外腔造成椎管容积变小者;3.严重的椎体骨折、椎体高度丢失70%以上,比较难以治疗者;4.稳定性骨折无症状者;5.需同时治疗3个以上节段者;6.胸腰椎爆裂骨折。
绝对禁忌症:1.出血性疾病或可能增加出血可能性的治疗;2.患者对手术器械或植入物有已知严重过敏反应;3.椎弓根骨折;4.椎体感染或存在未控制的全身感染。
(七)产品的研究要求
1.产品性能研究
需提供产品性能研究资料以及产品技术要求的编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法,采用的原因及理论基础。
虽然目前还没有完全适用于椎体成形球囊扩张导管的国家标准和行业标准,但是可以参照类似产品和相关产品的国家标准和行业标准,并结合实际使用情况制订相应的产品技术指标。例如可参照YY/T 0285.4-2017《血管内导管一次性使用无菌导管第4部分:球囊扩张导管》制订检验项目。由于两者适用范围及结构组成的不同,注册申请人还需根据申报产品工作原理、使用环境及产品特点制定性能指标。
可从以下几个方面对产品的性能进行研究:
充盈压力:球囊整体在工装内充盈时所承受的压力值。
额定充盈容积(cc):注册申请人规定的球囊最大充盈容积。
额定充盈压力(psi):由注册申请人规定的球囊最大工作压力。建议在受限条件下进行测试,球囊整体在匹配工装中模拟理想使用状态,在额定充盈压力保持一定时间,各连接处应无泄漏,各组件应无阻塞、爆裂等现象。
最大充盈压力(psi):球囊整体在匹配工装内,在高于额定充盈压力的情况下匀速缓慢升压,在球囊出现失效(如连接处或组件出现泄漏、爆裂等现象)前,可达到的最大压力。

疲劳性能:球囊整体在匹配工装内,从初始状态充盈至额定充盈压力(可保持一定时间),卸压后重复上述步骤,且各连接处应无泄漏、各组件无阻塞、爆裂等现象,记录重复次数。
插入力:球囊扩张导管在未充盈状态下通过工作套管插入所需的力。
鲁尔接头及连接件参见GB/T 1962系列标准。
注册申请人还可以根据产品具体的性能要求以及对产品认知水平的提高,补充其他性能研究资料。
2.生物相容性评价研究
(1)预期与人体接触的部分,均需要进行生物相容性评价,必要时进行生物学试验。
(2)实施或豁免生物学试验的理由和论证可参照《医疗器械生物学评价和审查指南》(国食药监械〔2007〕345号)中相关要求。
(3)生物学评价及试验可参考GB/T16886 系列标准。
3.灭菌工艺研究对于经环氧乙烷灭菌的产品,需提供灭菌结果确认和过程控制报告,具体可参照GB 18279系列标准。
对于经辐照灭菌的产品,需明确辐照剂量及相关的验证报告,具体的剂量确定依据可参照GB 18280系列标准。需评价辐照灭菌工序对于高分子部件性能的影响,并提供验证性能的确定依据、验证方案及报告,以及接受指标的确定依据。
4.产品有效期和包装研究
(1)注册申请人需按照《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》(国家食品药品监督管理总局通告2017年第75号)的要求,提交产品有效期研究确认资料。如果首次注册时提交的是加速老化验证资料,注册申请人需继续实际时间的老化试验。产品的实际时间的老化试验和加速老化试验需同时进行。依据YY/T 0681.1《无菌医疗器械包装试验方法第1部分:加速老化试验指南》对产品(包括包装)进行加速老化试验和实际时间的老化试验的方式验证其有效期。实时稳定性试验结果是验证产品货架有效期的直接证据。当加速稳定性试验结果与其不一致时,需以实时稳定性试验结果为准。
(2)注册申请人需提交包装研究资料,依据有关国内、国际标准进行(如GB/T 19633.1、GB/T 19633.2、ISO 11607、ASTM F2475、ASTM D4169等)对包装进行分析研究和评价。直接接触产品的包装材料的选择需至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适应性。
(3)根据《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》的要求,无论加速稳定性试验还是实时稳定性试验,注册申请人均需在试验方案中设定检测项目、检测方法及判定标准。检测项目包括产品自身性能检测和包装系统性能检测两方面。前者需选择与医疗器械货架有效期密切相关的物理、化学检测项目,涉及产品生物相容性可能发生改变的医疗器械,需进行生物学评价。如适用,可采用包装封口完整性检测用于替代无菌检测。后者则包括包装完整性、包装强度和微生物屏障性能等检测项目。其中,包装完整性检测项目包括染色液穿透法测定透气包装的密封泄漏试验、目力检测和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。
(八)产品的主要风险
注册申请人需根据YY/T 0316《医疗器械风险管理对医疗器械的应用》的要求,对产品全生命周期的各个环节实施风险管理,判断与产品有关的危险(源),估计和评价相关风险,控制这些风险并监视控制的有效性,确保剩余风险可接受。注册申请人提供注册产品的风险管理报告需扼要说明:
1.在产品的研制阶段,已对其有关可能的危险(源)及产生的风险进行了估计和评价,并有针对性地实施了降低风险的技术和管理方面的措施。
2.在产品性能测试部分中验证了这些措施的有效性,达到了通用和相应专用标准的要求。
3.对所有剩余风险进行了评价。
4.全部达到可接受的水平。
5.对产品的安全性的承诺。
表2、表3是依据YY/T 0316的附录E提示性列举了椎体成形球囊扩张导管可能存在危险的初始事件和环境,示例性地给出了危险、可预见的事件序列、危险情况和可发生的伤害之间的关系。
表2 产品主要初始危险因素
|
通用类别 |
初始事件和环境示例 |
|---|---|
|
不完整的要求 |
设计参数不恰当:产品耐压和耐疲劳性能差、连接不牢固,均可能导致手术无效或对使用者或患者造成机械损伤。 |
|
不完整的要求 |
性能要求不恰当:性能参数与实际使用情况不匹配,导致机械损伤。 与人体直接接触部件材料的生物安全性问题。 服务中的要求不恰当:使用说明书未对球囊扩张导管进行说明,球囊扩张导管不能正常使用。 产品货架寿命不恰当:在标识的灭菌有效期前,已无法保证产品的无菌。 |
|
制造过程 |
制造过程的控制不充分:生产过程关键工序控制点未进行监测,导致球囊扩张导管不合格。 供方的控制不充分:外购、外协件供方选择不当,外购、外协件未进行有效进货检验,导致不合格外购、外协件投入生产。 灭菌服务方控制不充分:未按照经确认的灭菌参数进行灭菌,导致灭菌失败。 |
|
运输和贮藏 |
不恰当的包装:产品防护不当导致产品运输过程中损坏或无菌失效。 不适当的环境条件:产品存放于极端恶劣的环境条件中,如不干净的仓库,长时间高温/低温、高湿的环境,造成产品受到污染。 |
|
清洁、消毒和 灭菌 |
清洁执行不恰当:未对产品清洁工艺进行确认或未按照确认过的参数进行清洁,导致清洁不彻底,产品有污染。 灭菌执行不恰当:未按要求对产品进行灭菌,或未达到灭菌效果。 灭菌后未按照要求进行解析,导致产品环氧乙烷残留量超标,对人体造成伤害。 |
|
处置和废弃 |
没提供信息或提供信息不充分:未在使用说明书中对产品处置和废弃方法进行说明,或信息不充分 |
|
材料 |
生物相容性:与人体接触的导管部分或其他部件选择不当可致过敏等反应。 |
|
人为因素 |
易混淆的或缺少使用说明书:如缺少详细的使用方法、缺少必要的警告说明;使用不适当的球囊规格;操作说明过于复杂,不易懂。 由缺乏技术的/未经培训的人员使用:使用者/操作者未经培训或培训不足,不能正确使用球囊导管。 |
表3 部分危险、可预见的事件序列、危险情况
和可发生的伤害之间的关系
|
危险 |
可预见的事件序列 |
危险情况 |
伤害 |
|---|---|---|---|
|
化学的 |
生产过程使用了加工助剂,注塑过程使用了工业脱模剂等,产品清洁不完全。 环氧乙烷残留。 |
带有化学残留的产品使用于人体。 人体接触超出限值的环氧乙烷。 |
刺激患者中毒,引起炎症,伤害人体健康。 |
|
生物学的 (微生物污染) |
灭菌效果不佳;包装材料不适合选用的灭菌方法,灭菌后材料老化;封口参数不合理,封口强度过低。 |
有微生物污染的器械使用于人体。 |
感染患者,进而感染与患者接触的人员。 |
|
生物相容性 |
产品无良好的生物相容性。 |
与人体组织不相容的器械使用于人体 |
中毒、刺激、过敏等症状,伤害患者健康,严重时危及患者生命。 |
|
功能 |
球囊导管的耐压、耐疲劳性能、连接强度不够;产品在射线下无法探测;与其他器械匹配度差;器械尺寸设计不合理,达不到/超过病椎位置。 |
医生无法使用器械,性能不合格的产品使用于人体。 |
手术中断,延长手术时间;球囊破裂导致手术失败或对患者造成机械损伤; 损伤到患者肌肉、椎体等非预期部位;瘫痪。 |
(九)产品技术要求的主要性能指标
根据球囊扩张导管的主要功能和预期用途,产品的技术指标主要包括产品的外观、尺寸、物理性能、化学性能和无菌性能等。不同注册申请人的产品参数根据设计要求可有所区别,并根据自身产品的技术特点制订性能指标要求,但不得低于相关强制性国家标准、行业标准的要求。
在技术要求中明确型号规格划分说明。
产品技术要求中规定的“性能指标”部分建议参考以下内容:
1.外观。
2.尺寸:导管有效长度、导管外径、球囊长度、囊体在额定充盈体积时的尺寸;支撑丝直径、长度。
3.预置支撑丝:耐腐蚀性、配合性能等。
4.球囊扩张导管的射线可探测性。
5.化学性能:重金属,酸碱度,蒸发残渣,吸光度等。
6.物理性能
(1)球囊扩张导管的耐压性能:额定充盈压力,该值一般不得低于300psi;
(2)连接部位连接强度;
(3)泄漏:球囊扩张导管的连接处或其他部分不应有液体泄漏。
7.无菌:产品应无菌。
8.环氧乙烷灭菌产品还应制定环氧乙烷残留量要求。
(十)同一注册单元内检验典型性产品确定原则和实例
在同一注册单元内所检验的产品需具有代表性。原则上不同类型的组件需分别选取典型性产品进行检验,还需综合考虑产品材质、结构以及功能的差异。
(十一)产品生产制造相关的要求
1.根据产品设计方案,明确产品工艺流程,提交工艺流程图,明确特殊过程和关键工艺,提供特殊过程的确认资料以及关键工艺的验证资料。如:产品的主要工艺有机加工、球囊成型、球囊折叠、熔接/粘接、清洗、组装、包装、灭菌等工序。如有外购组件,还需提供外购组件质量控制要求等信息。
2.注册申请人需提交研制、生产场地的相关信息。如有多个研制、生产场地,需概述每个研制、生产场地的实际情况。
(十二)产品临床评价要求
注册申请人需按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)的要求选择合适的临床评价路径提交临床评价资料。
1.同品种医疗器械评价路径
详见《医疗器械临床评价技术指导原则》中通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价要求。
2.临床试验评价路径
选择进行临床试验,则需严格按照《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局、中华人民共和国国家卫生和计生委员会令第25号)进行临床试验,并提交完整的临床试验资料。临床试验的设计可参考《医疗器械临床试验设计指导原则》(国家食品药品监督管理总局通告2018年第6号)。
境外注册注册申请人如有境外临床试验数据,可参照《接受医疗器械境外临床试验数据技术指导原则》(国家食品药品监督管理总局通告2018年第13号)的要求提交相关临床试验资料。
对于需要在境内开展临床试验的情况,开展临床试验研究前,制定临床试验方案时建议考虑以下因素:
(1)临床试验设计类型
为了保证试验结果的真实客观性和可比性,建议采用具有良好对照的前瞻性随机对照临床试验。采用其他临床试验,如成熟设计产品可考虑单组目标值方法,申办者需提供充分的理由解释试验结果的客观性和可靠性。
(2)入选标准
PKP主要用于骨质疏松导致的椎体压缩性骨折。
①年龄范围:一般为50-80岁的患者;
②骨骼情况:疼痛性骨质疏松椎体压缩骨折,骨密度提示存在骨量丢失或骨质疏松(DXA骨密度T值≤ -2.5),主诉有明显的腰背部疼痛,无神经压迫症状;有明确责任节段(体格检查提示病变部位与影像学检查确定的节段一致);
③疾病原因:骨质疏松性压缩骨折;
④充分知情并签署知情同意书。
(4)排除标准
①椎体后壁不完整患者;
②伴有精神疾病或老年痴呆患者;
③有手术禁忌者;
④因神经受压而导致的腰背痛及相应神经症状;
⑤椎体感染或存在未控制的全身感染;
⑥高能量损伤所致创伤性椎体骨折,椎体后壁破坏广泛,较大范围不完整、后方韧带复合体损伤者;
⑦受试者合并的其他疾病限制其参加研究,不能依从随访或影响研究的科学性完整性,如患有风湿性关节炎、强直性脊柱炎患者,筛选前30天内参加了其他药物或医疗器械临床试验;
⑧拒绝签署知情同意书。
(5)受试者退出标准及退出受试者的处理
退出标准:
①受试者撤回知情同意书;
②研究者认为不再适合继续进行临床试验者;
③受试者死亡;
④受试者失访;
⑤申办者要求终止试验。
退出受试者的处理:
①尽可能记录最后一次生命体征、术后情况和局部体征检查、影像学资料和不良事件等;
②将终止试验的时间和原因详细记录在病例报告表上;
③对因不良事件而终止试验的受试者必须随访至不良事件得到解决或稳定;
④医疗器械临床试验质量管理规范规定的其他相关事宜。
(6)临床试验评价指标及判定标准
①主要评价指标:推荐使用术后6个月的有效率。将“产品有效”定义为同时满足以下要求:影像学方面,椎体矢状位Cobb角矫正率至少达到30%;术后伤椎前缘高度比值至少达到70%。疼痛缓解方面,术后VAS评分应小于3分。
a.影像学评价:
矢状位Cobb角矫正率计算公式如下:
椎体矢状位Cobb角矫正率=(术前椎体矢状位Cobb角-术后椎体矢状位Cobb角)/术前椎体矢状位Cobb角×100%;
伤椎前缘高度比值计算公式如下:
伤椎前缘高度比值=伤椎前缘高度/伤椎上下椎体前缘高度的平均值×100%。
b.疼痛评价:
采用视觉模拟评分法(visual analogue scale,VAS)评估,共计10 分,分值越低,患者疼痛程度越轻。
②次要评价指标:
患者术后腰背部疼痛及功能状态(通常采用Oswestry功能障碍指数(Oswestry disability index,ODI)进行评价)、手术时间、骨水泥注入量、止痛药物服用情况等作为次要评价指标,综合评价临床试验结果。
安全性评价指标:是否存在骨水泥渗漏或产品部件失效引起的并发症;是否存在穿刺相关神经、脊髓损伤。
(7)临床试验观察时间
作为经皮椎体后凸成形术的关键工具,需对比术前和术后的治疗效果,相关观察指标的对比需包括术前、术后即刻以及术后1个月、3个月、6个月随访的各个观察点之间的对比。临床试验的持续时间取决于所有安全性和有效性数据的获得,建议至少随访至6个月,可根据实际情况适当延长,期间设置若干个观察点。
(8)对照产品的选择
对照产品需选择目前临床正广泛使用的、对相应适应证的疗效已被证实并得到公认的、来源于同一厂家生产的产品。对照产品的材料、设计、适应证与试验产品需具有可比性。需提供对照产品的选择依据。
(9)样本量的估算
样本量一般以临床试验的主要评价指标进行估算。需在临床试验方案中说明样本量估算的相关要素及其确定依据、样本量的具体计算方法。
提供所选样本量足以评价所申报产品有效性的统计学证据,至少包括以下内容:对照组与试验组主要评价指标下的预期疗效、预期的组间差异、检验界值、显著性水平(α)、把握度(β)、预期失访率、所用到的样本量计算公式或所使用的统计学软件、建议报告引用的参考文献等。
(10)人口统计学和基线特征
①人口统计学资料:如性别、年龄、身高、体重、骨密度及骨代谢指标等;
②临床疗效相关的基线数据:考虑因素包括疾病的节段和程度、临床分类等;
③既往病史:是否有营养不良(钙、磷、蛋白质、铁)、血友病、激素缺乏(生长激素、甲状旁腺素等)、放射治疗、吸烟、嗜酒、手术史、糖尿病史、过敏病史、长期服用糖皮质激素病史等。
(11)统计分析方法
需明示具体的统计分析方法以及统计分析软件及版本。
数据分析时需考虑数据的完整性,所有签署知情同意并使用了受试产品的受试者必须纳入分析。数据的剔除或偏移数据的处理必须有科学依据和详细说明。
临床试验的数据分析需基于不同的分析集,通常包括全分析集(Full Analysis Set,FAS)、符合方案集(Per Protocol Set,PPS)和安全集(Safety Set,SS),研究方案中需明确各分析集的定义。全分析集中脱落病例,其主要研究终点的缺失值的填补方法等需足够保守并在方案中事先予以说明,必要时需进行不同分析策略的灵敏度分析,以评价缺失数据对研究结果稳定性的影响。
主要研究终点指标的分析需同时在全分析集和符合方案集上进行;安全性指标的分析需基于安全集。
临床试验数据的分析需采用国内外公认的经典统计分析方法。临床试验方案需明确统计检验的类型、检验假设、判定疗效有临床意义的界值(非劣效界值)等,界值的确定需有依据。
对验证期间发生的所有不良事件的种类、严重程度、发生频率及与验证产品的关系将列表描述。
申办者需提供基于所有临床试验数据的统计分析报告,以便临床试验牵头单位根据此报告撰写临床试验总结报告。
(十三)产品的不良事件历史记录
通过搜集已上市产品的相关投诉及不良事件,椎体成形球囊扩张导管常见不良事件有:充盈或排空问题;插入困难;球囊破裂、卡塞、泄漏等。
(十四)产品说明书和标签要求
椎体成形球囊扩张导管的说明书和标签需符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)和YY/T 0466.1中的相关要求。
三、起草单位
本指导原则由国家药品监督管理局医疗器械技术审评中心编写并负责解释。

来源:国家药监局


