您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-04-24 20:09
药品补充检验方法和检验项目(以下简称“药品补充检验方法”)是掺杂掺假嫌疑药品认定检验的法定依据。药品补充检验方法的管理,涉及药品监督管理部门、药品检验机构和审评专家等相关方,包括方法起草、申报、审评和审批等环节。药品补充检验方法管理的质量和效率,直接影响认定检验的准确性与时效性,是管理改进的着眼点和评价的落脚点。
本文回顾药品补充检验方法管理发展过程,分析如何采用标准管理模式和流程优化与再造理论,提升管理效益。
从2003年至今,药品补充检验方法的管理可划分为四个阶段:一是2003至2014年的粗线条管理阶段,管理要求分散且缺乏系统性;二是2014至2015年的完善与酝酿改变阶段,修补现有管理模式,酝酿全面规范管理;三是2016至2018年的全面规范阶段,改革管理模式,重构管理流程。四是2020年以来追求高质量发展的阶段,实现新增方法密切结合监管需求。
2003年,原国家药品监督管理局发布《关于报请批准用补充检验方法和项目进行药品检验有关问题的通知》,启动药品补充检验方法的管理工作。管理条款内容相对简单,未细化管理流程,也未规范起草和复核的技术要求,影响管理效率和效益。尽管原国家食品药品监督管理总局于2014年在方法起草、复核等环节的程序和要求方面作出进一步规定,但10多年来管理中的问题已经累积并凸显。例如:申报审评效率低(管理流程冗长、标准物质可获得性影响审批);审评效益低(重复起草、方法质量参差不齐);已批准方法查找不便;起草申报积极性不高;管理方式相对落后。
2015年,针对药品补充检验方法管理中存在的问题,原国家食品药品监督管理总局自启动药品补充检验方法规范化管理研究工作。研究工作借鉴标准管理模式,采用流程优化与再造理论,形成《药品补充检验管理工作规程》《药品补充检验方法研制指南》,建立“药品补充检验方法信息管理系统”,优化和再造申报和审评流程,提高审批效率;规范方法起草和复核,提高批准方法质量,解决药品补充检验方法管理中存在的问题。
药品补充检验方法管理思路和模式的变化有:
01、借鉴标准管理模式
借鉴“国家标准”、“食品安全国家标准”和“医疗器械标准”管理的模式,《药品补充检验管理工作规程》规定了药品补充检验方法的起草与复核、申报与审评、批准与发布等标准管理重要节点,和审查方式、审查结论和审评委员会秘书处等标准管理关键要素,让药品补充检验方法的管理更完整更规范。
02、管理流程优化和再造
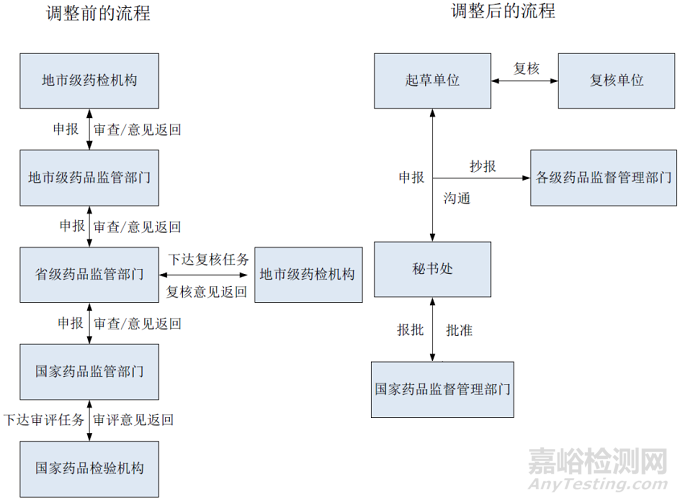
(1)减少申报层级,调整审查方式。将起草单位需经地方监管部门逐级行政审查后申报,调整为起草单位直接向秘书处申报;将报请行政机关审查改为抄报,保留同级及上一级监管部门对方法立项必要性审查的权利。
(2)删除不必要环节。将所有申报方法均需要先报送至国家药品监管部门,而后由国家药品监管部门向秘书处下达审查任务,调整为所有申报方法先经秘书处组织技术审查,秘书处仅将审查通过的方法报国家药品监管部门批准,删除国家药品监管部门转交方法的环节。
(3)确保审查环节运行顺畅。一是将方法技术复核提前。将秘书处形式审查后,再进行技术复核,调整为方法申报前需完成技术复核,既提高申报方法质量,又避免因等待复核结果而出现的停顿。二是将技术复核限定为上一级药品检验机构(如地市级药品检验机构申报方法的复核机构应为辖区省级药品检验机构),调整为由起草单位自行从秘书处推荐复核机构名单中选择,赋予起草单位选择灵活性,提高技术复核工作效率。
(4)解决重复申报,节约审查资源。鼓励起草单位在方法立项前与秘书处沟通,从源头上避免方法重复起草。对于审查中发现不同单位申报针对同一种掺杂掺假物的情形,由秘书处协调整合。
(5)明确激励措施,增加方法供给。将批准的药品补充检验方法视为科技成果,作为科研人员申请奖励和参加专业技术资格评聘的依据,调动药品检验机构起草方法积极性。
(6)明确关键环节工作时限。赋予方法起草、复核、审查、审批等关键环节工作时限,实现工作可预期。
调整前后的药品补充检验管理流程如图所示。
03、建立信息化管理系统
“药品补充检验方法信息管理系统”以信息化手段实现再造的管理流程,以电子信息传输取代纸质公文传递,提高运行效率。管理系统便利信息共享和公开,方便方法使用单位及时获取方法,起草单位及时获知申报与审查情况。
04、扩大标准物质认可范围,提高审批效率
《药品补充检验方法研制指南》适当扩大方法所用标准物质认可范围,不再限定于国家药品标准物质,还包括国家标准物质,以及来源明确、资料信息完整的标准试剂、标准参比物等阳性对照,提高方法审批效率。
05、规范药品补充检验方法起草和复核技术要求
借鉴中国药典标准起草和复核技术要求,建立《药品补充检验方法研制指南》,确保方法科学、合理和规范,提高起草和复核的质量。
为初步评价药品补充检验方法管理质量与效率改进效果,选择“申报方法与批准方法的比例”和“方法从申报到批准之间的耗时”两个指标,对比管理改进前后各3年的平均数据。结果显示,方法管理质量与效率均有了提升。
管理是一个以问题为导向,以质量与效率为目标的持续改进过程。2016年以来,药品补充检验方法管理开启了全面规范化模式,解决了管理的“上游”,即又快又好的申报和审批方法。下一步,则需要考虑管理的“下游”,包括方法应用评价、已批准方法变更管理、方法与标准提高的转换等,从而实现全周期的管理。

来源:Internet