您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-06-23 19:47
医疗器械说明书(以下简称说明书)是指由医疗器械注册人或者备案人制作,随产品提供给用户,涵盖该产品安全有效的基本信息,用以指导正确安装、调试、操作、使用、维护、保养的技术文件。也是注册申报必须提交的资料之一。
很多标准会将其分为技术说明书和使用说明书,使用说明书应包括设备使用过程中的一般信息及需要使用者特别注意的提示性内容, 而技术说明书是对专业的使用者或供应商允许的维修人员的技术性提示内容。在大多数情况下制造商会将使用说明书及技术说 明书的内容合并在一份随机文件中,这也是允许的。
那么说明书应该怎么编写呢?本文展开介绍一下,从以下几个方面:1.说明书涉及法规 2.说明书常见问题 3.说明书的自查清单,整篇文章依然是以有源医疗器械为例。
说明书涉及法规
有源医疗器械说明书涉及的相关法规主要有《医疗器械监督管理条例》、《医疗器械注册管理办法》、《医疗器械说明书和标签管理规定》《医疗器械通用名称命名规则》以及相关的国家标准、行业标准如GB9706.1、GB4793.1、YY0505、YY0709、YY0648、GB/T18268.1、GB/T18268.26、GB9706.25、YY0607、YY0670、GB4793.6、GB4793.9等等。
一、《医疗器械监督管理条例》,无论是680号令的第九条亦或是739号令的第十四条都有规定第一类医疗器械产品备案和申请第二类,第三类医疗器械产品注册时应提交有产品说明书;
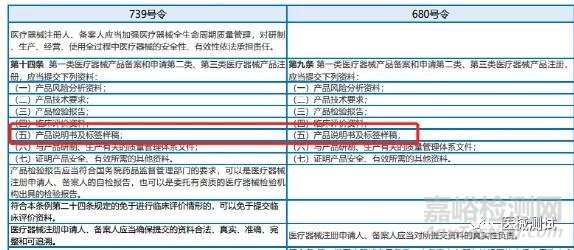
同时,680号令第二十七条或是739号令第三十九条规定医疗器械应当有说明书和标签,其内容应当与经注册或者备案的相关内容一致。应当标明以下事项:
(1)通用名称、型号、规格;
(2)医疗器械注册人、备案人、受托生产企业的名称、地址以及联系方式;
(3)生产日期和使用日期或者失效日期;
(4)产品性能、主要结构、适用范围;
(5)禁忌、注意事项以及其他需要警示或者提示的内容;
(6)安装和使用说明或者图示;
(7)维护和保养方法,特殊储存条件、方法;
(8)产品技术要求规定应当标明的其他内容。
第二类、第三类医疗器械还应当标明医疗器械注册证编号,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明。
二、《医疗器械注册管理办法》,第五十二条 医疗器械注册变更文件与原医疗器械注册证合并使用,其有效期与该注册证相同。取得注册变更文件后,注册人应当根据变更内容自行修改产品技术要求、说明书和标签。
三、《医疗器械说明书和标签管理规定》,共包括十九条,主要围绕医疗器械说明书和标签的内容编写和管理进行了规定,对说明书和标签的编制格式或样式没有规定,企业可自行设计说明书的格式或样式。关于该规定,要注意一下几点:
(1)第十条规定的医疗器械说明书一般应包括的内容,不应有遗漏,第十条规定了十四项说明书一般应包括的内容,其中有十三项要求是具体说明的,比如应包括:“(一)产品名称、型号、规格”,“(二)注册人或者备案人的名称、住所、联系方式和售后服务单位”,“(十三)说明书的编制或者修订日期”等。其中“(七)禁忌症、注意事项、警示以及提示性内容”应按照第十一条的规定进行编写。另外,对于重复使用医疗器械的说明书还应根据第十二条的规定编写有关重复使用的处理过程。
(2)说明书内容不应包含第十四条所规定的医疗器械说明书不得包括的内容。第十四条规定了八项说明书不得出现的内容,比如不应包括:“(一)含有“疗效最佳”、“保证治愈”、“包治”、“根治”、“即可见效”、“完全无毒副作用”等表示功效的断言或者保证”,“(三)说明治愈率或者有效率的”和“(四)与其他企业产品的功效和安全性相比较的”等。
(3)说明书上标明的产品名称应当使用通用名称,注册申请人应依据《医疗器械通用名称命名规则》的规定明确产品名称,并在说明书的显著位置清晰标明。
(4)说明书中出现的疾病名称、专业名称、度量衡单位、符号及识别颜色等应符合第五条、第六条的要求。
四、其他的一些标准,可以参考产品技术要求,比如有源医械电气安全标准GB9706.1-2007和电磁兼容标准YY0505-2012,报警标准YY0709-2009以及IVD器械的电气安全标准GB4793.1-2007和电磁兼容标准GB/T18268.1及GB/T18268.26和专标YY0648-2008,当然还有其他很多产品的专用标准,不再一一列举,这些通用的总结了一下,形成了一个自检表供大家写好说明书后自行查阅,当然还要加上你们产品适用的专标(如果有的话),一般可能一有一两个章节。
以YY0505为例:
Y Y 0505 中对于随机文件的要求分为使用说明书和技术说明书两部分,编写使用说明书时,制造商应注意在使用说明书写明有关电磁兼容的提示和安装和使用中对电磁兼容性有影响的信息的说明 , 还要提示便携式和移动式射频通信设备 , 如手机或对讲机等可能影响医用电气设备。
对于带有一些信号接口 , 其插针又不能通过标准规定的静电放电试验的设备, 需要在使用说明书中对设备上标示ESD警示符号进行说明 , 还要警示操作者不能在无ESD预防措施的情况 下接触标有 ESD 警示符号的连接器的插针。
如果设备没有手动灵敏度调节 , 或者制造商规定了患者生理信号最小幅值或最小值 , 使用说明 书要说明患者生理信号的最小幅值或最小值 ,并且警示设备以低于上述最小幅值或最小值运行可能导致不准确后果。
编写技术说明书时要列出能够使其符合发射和抗扰度要求的所有电缆、电缆的最大长度、换能器及其它附件(不影响符合电磁兼容性要求的附件可以不列出 )的必要信息。还要警示使用其它的附件换能器和电缆可能导致设备或系统发射的增加或抗扰度的降低。对于电磁发射信息需要按照 YY 0505中图201或图2 02的流程逐项填写表201。对于抗扰度的信 息需要按照 YY 0505 中图 203 的流程逐项填写表202 。
对于大多数设备, 是不需要在屏蔽场所使用的 , 随机文件要提供对于射频传导和射频辐射抗扰度的声明 , 如果是生命支持设备按 YY 0505 中表 203 和 205 提供声明 , 如果是非生命支持设备和系统则按表 204 和 206 声明 。经过风险分析, 某些医用电气设备的性能下降不会造成安全上的风 险, 也即其没有基本性能 , 这类设备的抗扰度试验在检测时是可以不测的 , 这时随机文件要包括设备或系统未进行电磁骚扰抗扰度试验的说明 。
说明书常见问题
说明书最容易出现的问题或容易发补的问题通常是因为常规内容不全,较为常遗漏的常规内容如下。
1、产品型号、规格;
2、注册人或者备案人的名称、住所、联系方式及售后服务单位,进口医疗器械还应当载明代理人的名称、住所及联系方式;
3、生产企业的名称、住所、生产地址、联系方式及生产许可证编号或者生产备案凭证编号,委托生产的还应当标注受托企业的名称、住所、生产地址、生产许可证编号或者生产备案凭证编号;
4、医疗器械注册证编号或者备案凭证编号;
5、产品技术要求的编号;
6、产品性能、主要结构组成或者成分、适用范围;
7、禁忌症、注意事项、警示以及提示的内容;
8、安装和使用说明或者图示,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明;
9、产品维护和保养方法,特殊储存、运输条件、方法;
10、生产日期,使用期限或者失效日期;
11、配件清单,包括配件、附属品、损耗品更换周期以及更换方法的说明等;
12、医疗器械标签所用的图形、符号、缩写等内容的解释;
13、说明书的编制或者修订日期;
14、其他应当标注的内容。
说明书中关于医疗器械产品名称的常见问题,一般如果按照命名规则,不能准确表达产品宣传的直观效果,产品名称是否可以由企业自定?
从法规要求而言,并非企业不能自定名称,但得符合命名的规则,而经注册的产品名称不得自行更改注册相关的资料,例如,注册的说明书中的名称,与正式印刷和销售随机附产品的说明书名称须一致。如若非要涉及商品名,则在注册时可列明商品名称。
在《医疗器械通用名称命名规则》中,医疗器械通用名称除应当符合本规则第六条的规定外,不得含有下列内容:
1、型号、规格;
2、图形、符号等标志;
3、人名、企业名称、注册商标或者其他类似名称;
4、“最佳”、“唯一”、“精确”、“速效”等绝对化、排他性的词语,或者表示产品功效的断言或保证;
5、说明有效率、治愈率的用语;
6、未经科学证明或者临床评价证明,或虚无、假设的概念性名称;
7、明示或暗示包治百病,夸大适用范围,或其他具有误导性、欺骗性的内容;
8、“美容”、“保健”等宣传性词语;
9、医疗器械通用名称不得作为商标注册;
10、有关法律、法规禁止的其他内容。
医疗器械说明书中的警示以及提示性内容,在产品使用中涉及的各注意事项、警示及提示,通过对产品的风险分析可得出,进行制定出相适宜的说明书涉及安全使用的内容。
依据《医疗器械说明书和标签管理规定》第十一条,医疗器械说明书中有关注意事项、警示以及提示性内容主要包括:
1、产品使用的对象(例如:家用还是医用、是否具有某些特殊培训的医生使用等);
2、潜在的安全危害及使用限制(例如:远离某些有害有毒气体的场所等,禁止某些使用条件);
3、产品在正确使用过程中出现意外时,对操作者、使用者的保护措施以及应当采取的应急和纠正措施(例如:漏电的保护、有害液体外溅的保护、辐射保护等措施);
4、必要的监测、评估、控制手段(例如:产品的失效判定手段和解决方法);
5、一次性使用产品应当注明“一次性使用”字样或者符号,已灭菌产品应当注明灭菌方式以及灭菌包装损坏后的处理方法,使用前需要消毒或者灭菌的应当说明消毒或者灭菌的方法(例如:EO环氧乙烷灭菌、甲醛、茂二醛、邻苯二甲、过氧乙酸、臭氧消毒);
6、产品需要同其他医疗器械一起安装或者联合使用时,应当注明联合使用器械的要求、使用方法、注意事项;
7、在使用过程中,与其他产品可能产生的相互干扰及其可能出现的危害(例如:电磁干扰等各种可能影响的环境干扰和危害);
8、产品使用中可能带来的不良事件或者产品成分中含有的可能引起副作用的成分或者辅料;
9、医疗器械废弃处理时应当注意的事项,产品使用后需要处理的,应当注明相应的处理方法;
10、根据产品特性,应当提示操作者、使用者注意的其他事项。
另外还有说明书中载明的产品名称、型号规格、结构组成、适用范围等内容与经注册或者备案的内容不一致,产品性能与产品技术要求、注册检验报告内容不一致等情况出现。
之前北京审评培训时的讲解,国抽不合格情况如下:
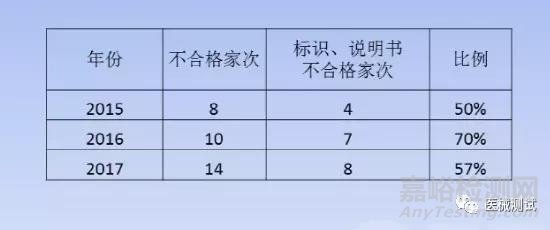
问题举例
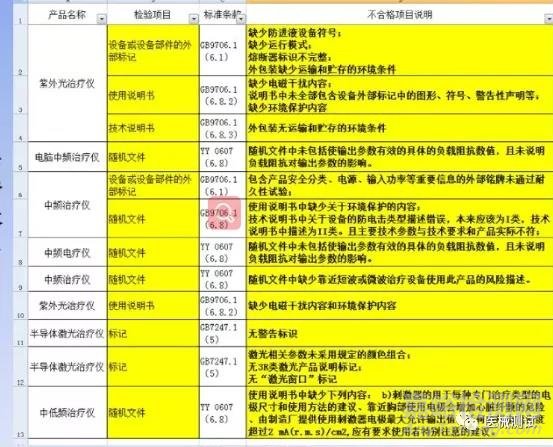
说明书自查清单
为了能更好编写好说明书,整理一个自查清单以供参考,可以在编写说明书时对照用,编写完也可以结合表逐条比对, 查漏补缺,自查清单只是上述涉及到的一些通用的,产品专标规定的内容注意关注下,要加上去。

来源:医械测试


