您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-04 12:52
2021.11.04,FDA官网发布器械软件功能递交文档草稿指南,即,Content of Premarket Submissions for Device Software Functions,以替代2005年发布的指南Guidance for the Content of Premarket Submissions for Software Contained in Medical Devices,主要是为了更新FDA关于审核上市前递交文档中软件功能的想法。
此草稿指南,主要有如下变化:
1. 新增了文档水平的概念,即,Documentation level,将软件文档区分为Basic Documentation, Enhanced Documentation这两大类,而2005版指南是根据软件风险等级(Level of Concern)来提供不同详略度的文档。
• Basic documentation ,即当判断不用提交Enhanced documentation时需提供的软件文档。(be provided for any premarket submission that includes device software functions where Enhanced Documentation does not apply.)
• Enhanced documentation是要在满足以下四个任一条件时需提供的软件文档:
1) 器械是组合产品的一部分;
2) 器械(a)用于检测献血者是否存在输血传播感染;或(b)用于确定捐赠者和接受者的兼容性;或(c)是一个血液建立计算机软件。
3) 器械属于III类;
4) 器械软件功能的故障或潜在缺陷可能对患者、用户或使用环境中的其他人造成死亡或严重伤害的风险。在实施风险控制措施之前,应对这些风险进行评估。应考虑在器械的预期使用范围内的风险;对安全、治疗和/或诊断的直接和间接影响;以及其他相关考虑。
草稿指南文末有如何判断软件文档水平的示例,大家有兴趣可以看看,其中一个示例如下:
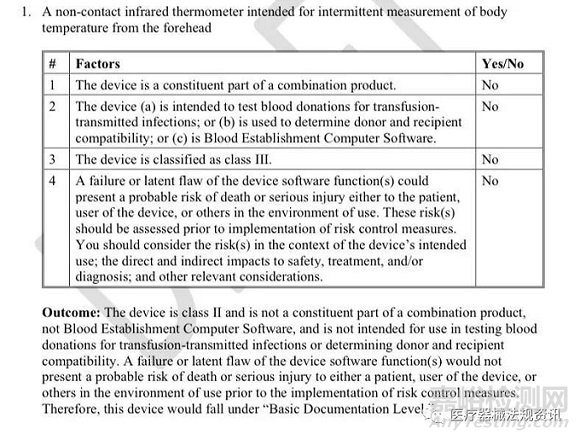
2. 从文档框架上才看,Traceability Analysis不再作为递交文档的一部分,后续视审核要求提供或不提供。
3. 新增几个术语描述:
• Device Software Function,即,符合FD&C Act中201(h)中器械定义的软件功能,可以是器械预期用途,也可以是器械预期用途的一部分,
• Off-the-Shelf Software,即,市售软件,
• Software as a Medical Device (SaMD),即,独立软件,
• Software in a Medical Device (SiMD),即,软件组件

来源:医疗器械法规资讯


