您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-12 22:23
对于D类器械,IVDR法规第48(6)条规定了公告机构是否需要就制造商的性能评估报告咨询专家小组的适用条件。这些条件是:
(1)没有D类器械的通用规范(CS),
(2)并且也是该类器械的首次认证。
对于这些条件的含义以及公告机构应遵循的相应程序您可能会有疑问,下面海河生物来给大家解读一下。
01、根据法规(EU) 2017/746第48(6)条,“该类器械的首次认证”是什么意思?
如IVDR的序言部分(53)所述,如果这是该特定类型设备的首次认证,且市场上没有具有相同预期用途和基于类似技术的类似器械,公告机构应咨询专家小组。因此,IVDR第48(6)条中对该类型器械的首次认证可以被理解为公告机构根据指令98/79/EC或法规(EU) 2017/746对以下特定产品的首次认证:
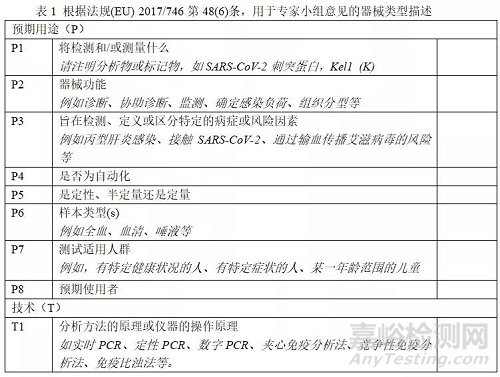
预期用途,包括以下所有用途:
将检测和/或测量什么,
器械的功能,如筛选、监测、诊断等,
旨在检测、定义或区分特定的病症或风险因素,
是否为自动化,
是定性、半定量还是定量,
所需样本类型,
测试适用人群,
预期使用者。
所使用的分析技术和过程,包括:
分析方法的原理或仪器的操作原理。
一旦带有上述特定要素的器械根据指令98/79/EC或法规(EU) 2017/746获得认证,任何根据法规(EU) 2017/746首次申请认证的具有类似要素集的其他设备,无论制造商是谁,都将被视为同一类型的设备,并且不需要专家小组的参与。
02、公告机构应该遵循什么程序来确定一个给定的认证是否是该类器械的首次认证?
公告机构必须决定有关器械的认证是否为该类器械的首次认证。这意味着,公告机构应判断器械类型定义的上述要素是否与已认证的器械相似,以便将其视为同一类型。公告机构应基于以下内容做出决定:
运用自己的知识和专长;
考虑制造商提供的资料,包括相关研究(例如科学和市场研究);
考虑下面第3点问题所述的专家小组已经完成和正在进行的协商的有关器械类型的资料。
如果公告机构得出结论,该类型的器械尚未根据指令98/79/EC或法规(EU) 2017/746通过认证,并且该器械没有通用规范,公告机构必须咨询专家小组。公告机构应记录其评估某一给定的认证是否是该类器械的首次认证的内容及相应的结论。
03、公告机构应如何在提交给IVD专家小组的文件中指明器械的类型?
在咨询IVD专家小组时,公告机构应提供下表中所要求的信息作为提交文件的一部分。由公告机构正式完成的器械描述信息将在专家小组的网站上公布,供专家小组持续商讨使用。一旦专家小组发表了意见,该信息将成为意见的一部分。
04、第48(6)条中“没有CS”是什么意思?
这可以理解为没有采用通用规范的情况下,发表在欧盟官方期刊的特定器械类型。通用规范发布后,CS被认为是“可用的”,这种情况不需要咨询专家小组。
05、如果公告机构确认专家小组正在对该类型设备进行咨询,公告机构应如何处理认证过程?
这个问题与就该类型器械的首次认证咨询专家小组的公告机构无关,而是与首次认证咨询仍在进行且可能正在处理第二次、第三次认证的公告机构有关。在专家小组就该类型器件的首次认证进行咨询并发表意见之前,公告机构不应颁发证书,并且建议公告机构在决定颁发证书时考虑专家小组的意见。

来源:海河生物


