您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-02 11:38
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.利妥昔单抗获批治疗类风湿关节炎。复宏汉霖利妥昔单抗生物类似药汉利康®(HLX01)新适应症获国家药监局批准上市,用于治疗类风湿关节炎。值得一提的是,目前原研利妥昔单抗还未在国内获批这项适应症。汉利康是中国获批的首个生物类似药,已获NMPA批准用于非霍奇金淋巴瘤和白血病的治疗,全面覆盖原研利妥昔单抗在中国获批的所有适应症。
2.四环医药「加格列净片」报NDA。四环医药开发的「加格列净片」的新药上市申请获CDE受理,用于治疗2型糖尿病。加格列净是国产第2款申报上市的SGLT-2抑制剂,也是四环制药第2款申报上市的1类新药,已在中国、美国、欧洲、日本和韩国获得专利权。与传统的降糖药物相比,SGLT-2抑制剂具有药效持久,不易发生低血糖风险、降低糖尿病患者体重,每日口服一次便捷给药等特征优势。
3.国药脊灰灭活疫苗通过WHO预认证。国药集团中国北京生物制品研究所开发的Sabin株(Vero细胞)脊髓灰质炎灭活疫苗(sIPV)日前已通过了世卫组织的预认证,被列入世卫组织采购清单,可供联合国系统采购。据悉,这是我国第七个通过WHO预认证的国产疫苗。脊髓灰质炎(脊灰)是由脊灰病毒引起的急性肠道传染病,是继天花后全球第二个拟将消灭的传染病。
4.勃林格殷格翰IL-36R单抗拟纳入优先审评。勃林格殷格翰申报的IL-36R抑制剂司柏索利单抗注射液(spesolimab)上市申请获CDE拟纳入优先审评,用于治疗成人泛发性脓疱型银屑病(GPP)发作。在一项Ⅱ期临床中,spesolimab可有效快速地治疗GPP成人患者的急性发作,且有潜力仅在一周后就能完全清除GPP急性发作的体征和症状,并维持治疗效果长达12周。此前,该疗法已被CDE纳入突破性治疗品种。
5.众生药业流感新药在美获批临床。众生药业旗下众生睿创一类创新药物ZSP1273片获FDA临床试验默示许可。ZSP1273是众生睿创针对重大突发传染性疾病——甲型流感及人禽流感研发的具有明确作用机制和自主知识产权的一类创新药,已在国内开展的Ⅱ期临床中取得积极的有效性结果,ZSP1273 600 mg QD组较安慰剂组,能缩短七项流感症状缓解时间和发热缓解时间,并且在病毒学相关的次要指标均达到统计学显著性差异。
国际药讯
1.Opdivo治疗ESCC获欧盟CHMP推荐。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准百时美施贵宝PD-1疗法Opdivo(欧狄沃,纳武利尤单抗)联合化疗(含氟尿嘧啶+顺铂),一线治疗PD-L1≥1%、不可切除性晚期、复发或转移性食管鳞状细胞癌(ESCC)成人患者。在一项关键Ⅲ期CheckMate-648试验中,与化疗相比,Opdivo联合化疗显著改善患者的总生存期(中位OS:15.4个月vs9.1个月;HR=0.54;99.5%CI:0.37-0.80;p<0.001)。
2.艾伯维伊布替尼儿科适应症报sNDA。艾伯维BTK抑制剂Imbruvica(伊布替尼)已向FDA提交补充新药申请(sNDA),用于治疗1岁以上儿童和青少年慢性移植物抗宿主病(cGVHD)经治患者。该公司还提交了Imbruvica口服混悬剂的新药申请(NDA),为儿科患者提供替代给药选择。在一项Ⅰ/Ⅱ期临床中,Imbruvica用于儿科患者的总缓解率为78%,而且安全性与已知研究一致。
3.安进/阿斯利康哮喘新药临床数据积极。安进在AAAAI2022年会上公布TSLP单抗Tezspire(tezepelumab-ekko)治疗严重哮喘患者关键Ⅲ期NAVIGATOR试验和Ⅱb期PATHWAY试验的汇总分析结果。无论基线血液嗜酸性粒细胞计数如何,治疗52周期间,与安慰剂+标准护理(SoC)相比,Tezspire联合SoC治疗均显著降低年化哮喘加重率(AAER),三个剂量组降幅分别为71%(≥300个细胞/微升)、48%(<300个细胞/微升)、48%(<150个细胞/微升)。Tezspire已于去年12月获FDA批准上市,是首款治疗严重哮喘没有表型或生物标志物限制的生物制剂。
4.Opdivo辅助治疗肺癌获优先审评资格。FDA受理百时美施贵宝PD-1抑制剂Opdivo(nivolumab)的sBLA申请,联合化疗用于辅助治疗可切除非小细胞肺癌(NSCLC)。FDA同时授予该申请优先审评资格。在关键Ⅲ期临床CheckMate-816中,与术前单独化疗相比,Opdivo联合化疗组患者无事件生存(EFS)和病理完全缓解率均具有统计学意义的改善。如果获批,Opdivo组合将成为首款治疗可切除NSCLC的免疫疗法组合。
5.基因编辑治疗ATTR早期临床积极。Intellia公司与再生元联合开发的CRISPR/Cas9基因编辑疗法NTLA-2001,在治疗转甲状腺素蛋白淀粉样变性(ATTR)的Ⅰ期临床最新数据积极。在治疗的28天后,每公斤体重给药0.1毫克、0.3毫克、0.7毫克和1.0毫克的治疗组中,TTR蛋白的水平分别下降52%、87%、86%和93%。在随访时间为2到12个月的间隔里,血清TTR蛋白的降低水平维持稳定。所有的给药剂量都耐受良好。
6.Blueprint超6亿美元布局新型蛋白降解疗法。Blueprint Medicines与Roivant Sciences旗下的Proteovant Therapeutics达成一项战略性合作,利用Proteovant基于AI的靶向蛋白降解(TPD)技术平台,针对“难以成药”靶标合作开发两款用于治疗癌症和血液学疾病的新型靶向蛋白降解候选疗法。根据协议,Proteovant将获得2000万美元的预付款,可能高达6.32亿美元的潜在里程碑付款,以及产品的销售分成。Blueprint Medicines将拥有开发和商业化合作产品的独家选择权。
医药热点
1.浙江21家中医医院通过三级评审。浙江省公布第四周期首批21家三级中医医院名单。其中,杭州市中医院、杭州市萧山区中医院、宁波市中医院、温州市中医院、嘉兴市中医医院、绍兴市中医院、诸暨市中医医院、义乌市中医医院、温岭市中医院、丽水市中医院、浙江中医药大学附属第三医院共11家医院为三级甲等。此次还评出3家三级甲等中西医结合医院,2家三级甲等中医骨伤医院,3家三级乙等中医医院,2家三级乙等中医骨伤医院。
2.华西天府医院启用“日归”手术中心。2月28日,全国首家只做“日归”手术的日间手术中心在四川大学华西天府医院启用。华西天府医院日间手术中心与华西医院日间手术中心一体化、同质化管理,共设床位54张,分为两个病区,分批次开放。前期开展日间手术的科室主要包括:乳腺外科、消化内科、眼科、疼痛科、美容整形外科、疝与腹壁外科等。
3.中国重型β-地贫患者疾病经济负担报告发布。山东大学卫生管理与政策研究中心、国家卫健委卫生经济与政策研究重点实验室和北京新阳光慈善基金会共同发布“中国重型β-地中海贫血成人患者疾病经济负担报告”。定量结果显示,84%的患者目前仍以输血和祛铁治疗为主,42.0%的患者未按时按量输血,血源不足是主要原因(26.5%)。近四成(38.3%)的患者未能坚持规范化祛铁治疗,其中超过六成(61.3%)因祛铁费用高而中断治疗。
评审动态
2. FDA新药获批情况(北美02月28日)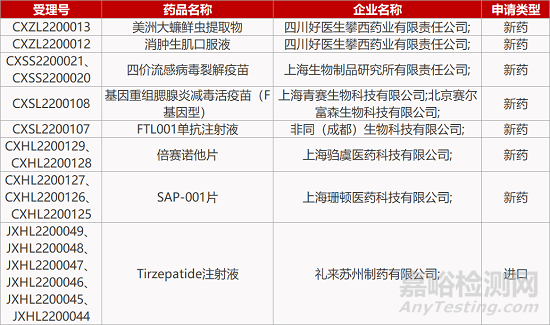
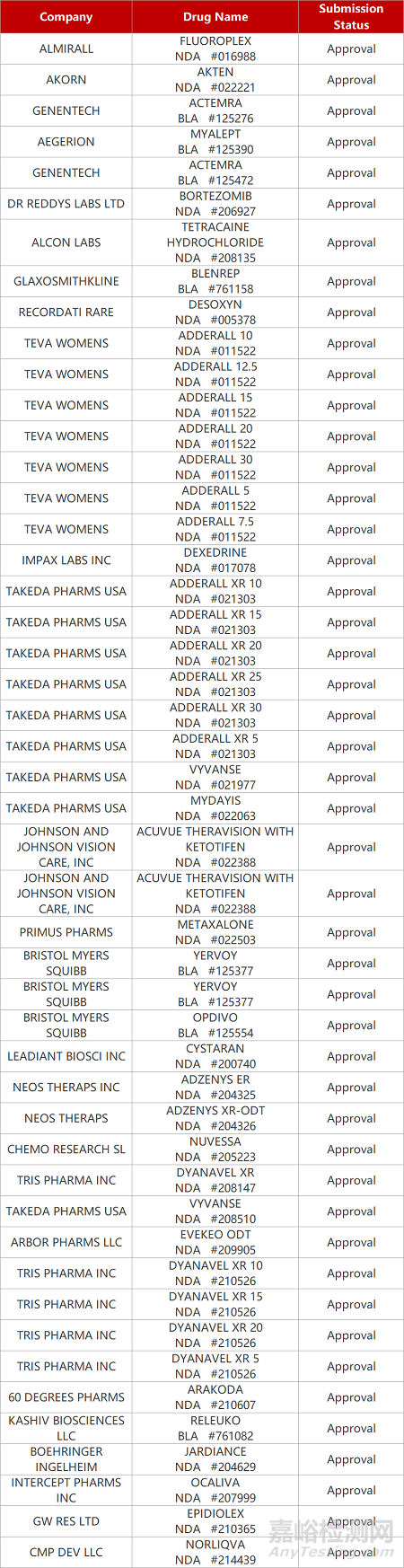

来源:药研发


