您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-18 10:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
百奥泰B7-H3靶向ADC获批临床。百奥泰ADC新药BAT8009获国家药监局临床试验默示许可,拟用于晚期实体瘤的治疗。BAT8009是一款靶向B7H3的ADC药物, 由重组人源化抗B7-H3抗体与毒性小分子拓扑异构酶I抑制剂,通过自主研发的可剪切连接子连接而成。B7-H3是B7家族的一个跨膜蛋白,在包括肺癌、前列腺癌、乳腺癌等多种癌症中过度表达,而且其过度表达与不良预后相关。此前国内仅翰森制药的同类药物处于临床早期开发阶段。
国内药讯
1.施维雅伊立替康脂质体在华获批上市。施维雅公司胰腺癌治疗药物易安达(盐酸伊立替康脂质体注射液,Onivyde)获NMPA批准上市,与5-氟尿嘧啶(5-FU)和亚叶酸(LV)联用治疗接受吉西他滨治疗后进展的转移性胰腺癌患者。Onivyde是一种拓扑异构酶抑制剂,这种脂质体制剂的设计,可保护伊立替康不会被早期转化为活性代谢物SN-38,有助于伊立替康在体循环中保持更长时间,增强抑制肿瘤生长。该药此前已在全球多个国家和地区获批。
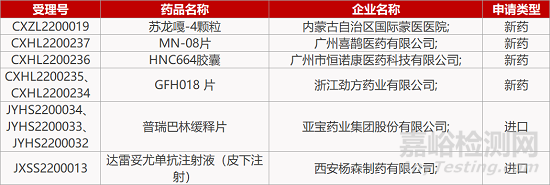
2.强生皮下注射复方新适应症报产。强生旗下杨森CD38单抗达雷妥尤单抗注射液(皮下注射)的新适应症上市申请获CDE受理。达雷妥尤单抗皮下注射剂(DARZALEX FASPRO)是达雷妥尤单抗和重组人透明质酸酶PH20组成的固定剂量复方,与该产品静脉注射剂相比,皮下注射剂能够将患者的给药时间从几小时缩短到几分钟。此前,该产品已在中国获批用于原发性轻链型淀粉样变患者。
3.FIC疱疹病毒抑制剂在华获批临床。AiCuris公司HSV复制抑制剂pritelivir薄膜包衣片(AIC316)获国家药监局临床试验默示许可,拟用于治疗免疫力低下且对阿昔洛韦耐药的皮肤黏膜单纯疱疹病毒(HSV)感染。AIC316具有全新的作用机制,目前正在一项国际Ⅱ/Ⅲ期临床PRIOH-1中评估用于上述适应症治疗的有效性与安全性。基于这项Ⅱ期临床的积极结果,AiCuris公司计划在美国、欧洲和中国开展关键Ⅲ期临床试验。
4.海思科BTK靶向PROTAC在美获批临床。海思科自主研发的靶向BTK的口服PROTAC小分子抗肿瘤药物HSK29116获FDA临床默示许可。HSK29116具有选择性阻断BTK激酶活性和蛋白酶体降解双重抗肿瘤活性,通过调节信号通路干预B细胞发育,控制各种B细胞恶性肿瘤的进展,拟开发用于治疗复发难治B细胞淋巴瘤。目前该新药正在国内和澳大利亚开展国际I期临床,美国临床将作为这项全球多中心研究的重要组成部分。
5.西岭源治疗IBS创新药获批临床。西岭源药业旗下深圳科岭源研发的首款1类创新药SMP-100片获国家药监局临床默示许可。SMP-100是全球目前唯一针对肠易激综合征(IBS)的5-羟色胺3(5-HT3)受体部分激动剂,,深圳科岭源拥有SMP-100及其衍生物的全球独家开发和商业化权益。SMP-100已在澳洲开展的I期临床中显现出良好的耐受性和安全性,预今年第四季度进入II期临床。
国际药讯
1.礼来IL-13抗体皮炎Ⅲ期临床积极。礼来IL-13抑制剂lebrikizumab与外用皮质类固醇联用,在治疗中重度特应性皮炎的Ⅲ期临床达到所有主要和关键次要终点。与安慰剂加外用皮质类固醇组相比,这一组合16周时患者达到皮肤光洁或接近光洁程度的患者比例更高(41%vs22%),疾病严重程度改善至少75%的比例也更高(70%vs42%)。此前,FDA已授予lebrikizumab用于中重度特异性皮炎的快速通道资格。
2.CD3/D20双抗治疗LBCL早期临床积极。艾伯维和Genmab公司联合开发的CD3/D20双抗epcoritamab,在治疗复发和难治性大B细胞淋巴瘤(LBCL)的I/II期Epcore NHL-1试验获积极顶线结果。根据独立审查委员会评估,该疗法的总体响应率达到63.1%,反应的中位持续时间高达12个月。目前,epcoritamab正在Ⅲ期临床中评估单独用于治疗复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者的疗效。
3.默沙东21价PCV获突破性疗法认定。FDA授予默沙东开发的21价肺炎球菌结合疫苗V116突破性疗法认定,用于在18岁以上成人中预防侵袭性肺炎球菌病(IPD)和由肺炎链球菌血清型3、6A/C、7F、8、9N、10A、11A、12F、15A、15B/C、16F、17F、19A、20、22F、23A、23B、24F、31、33F、35B引起的肺炎球菌性肺炎。V116包括了目前获批疫苗未涵盖的8种血清型。默沙东计划今年晚些时候启动V116的Ⅲ期临床。
4.Be Biopharma拟加速开发新型B细胞疗法。Be Biopharma宣布完成1.3亿美元的融资,计划在罕见疾病和肿瘤学治疗领域推进其专有的自体和异体工程化B细胞医药(BeCM)平台,并将候选疗法推进至临床开发。BeCM平台能够利用精准基因编辑改造B细胞并构建新型的细胞疗法,它们能够在体内持久地产生治疗性蛋白,并且具有潜在的剂量滴定潜力,可在需要时重新给药,而且不需要毒性预治疗。
5.再生元新冠鸡尾酒遭FDA延迟审查。FDA延长再生元中和抗体REGEN-COV用于治疗非住院COVID-19患者和作为某些个体预防措施的生物制品许可申请(BLA)的审查期,将PDUFA日期延至7月13日。FDA认为需要额外的时间审查该疗法在接触SARS-CoV-2病毒之前针对COVID-19预防效果(暴露前预防)的更多数据。此前,REGEN-COV用于治疗轻中度COVID-19已获得FDA授予紧急使用授权(EUA),然而由于最新的试验数据未能显示REGEN-COV对Omicron有效,FDA于今年1月针对该疗法发布了限制性公告。
6.BMS/Nektar终止全球临床合作。Nektar公司和百时美施贵宝联合宣布,基于对偏向性IL-2通路激动剂bempegaldesleukin (BEMPEG)联合PD-1抑制剂Opdivo(纳武利尤单抗)治疗肾细胞癌(RCC)和膀胱癌的两项后期临床(III期PIVOT-09研究和II期PIVOT-10研究)的分析结果,两家公司决定终止BEMPEG联合Opdivo的全球临床开发。包括针对肌肉浸润性膀胱癌(CA045-009)的关键研究,针对1L RCC (CA045-011)的双药联合TKI(CA045-011)的I/II期研究,以及针对复发和/或难治性儿童肿瘤(CA045-020)的I/II期研究,所有研究都将终止。
医药热点
1.北京卫健委不同意两家医院暂停肠道门诊。4月15日,北京市卫健委官网发布《北京市卫生健康委员会关于不同意北京大学人民医院暂停肠道门诊的批复》和《北京市卫生健康委员会关于不同意首都医科大学附属北京天坛医院暂停肠道门诊的批复》。北京市卫健委要求,在做好新冠疫情防控的同时,两家医院应合理安排腹泻患者就诊区域,或设置肠道门诊专室,为腹泻患者提供规范便捷服务。
2.上海16例重症患者仅有1例接种过疫苗。4月16日0至24时,上海新增本土新冠确诊病例3238例和无症状感染者21582例,其中1177例确诊病例为此前无症状感染者转归,1754例确诊病例和21167例无症状感染者在隔离管控中发现,其余在相关风险人群排查中发现。上海目前有重型病例16例,最小1例33岁,其他都是70岁以上的老年人,这16例当中,只有1例已全程接种疫苗。
3.福建试点药学服务费。4月14日,福建省医保局发布《关于在省属公立医院试行药学服务收费政策的通知》。通知给出了包括药物治疗门诊、静脉药物配置费、血清药物浓度测定、各类滥用药物筛查、用药指导的基因监测、多学科综合门诊、住院诊察费等15项药学服务的具体收费标准,规定自2022年7月1日起试行一年。
评审动态

来源:药研发


