您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-06 11:18
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
达石不成瘾镇痛药早期临床积极。达石药业靶向神经生长因子(NGF)的抗体类药物DS002在I期临床中获得安全性研究数据。这是一项评价DS002注射液单次给药在健康受试者中的安全性、耐受性、药代动力学及免疫原性的随机、双盲、剂量递增、安慰剂对照的临床研究。DS002通过结合NGF阻断与伤害性感受器表面的TrkA结合,达到无成瘾、强效镇痛效果,拟用于治疗疼痛适应症。
国内药讯
1.智飞新冠疫苗Ⅲ期临床见刊NEJM。新英格兰医学杂志(NEJM)发表重庆智飞与中国疾控中心开发的重组蛋白新冠疫苗ZF2001三剂接种的Ⅲ期临床(NCT04646590)试验结果。该项试验在乌兹别克斯坦、印度尼西亚、巴基斯坦和厄瓜多尔开展。随访6个月期间,ZF2001三剂接种后预防有症状感染的保护力为75.7%(95%CI 71.0-79.8),预防重症、危重保护力为86.5%(95%CI 38.9-98.5)。疫苗组和安慰剂组的不良事件发生率相当,无严重的疫苗不良反应。
2.礼来双靶点降糖新药获批OSA临床。礼来GLP-1R/GIPR双重激动剂Tirzepatide获CDE临床默示许可,用于中重度阻塞性睡眠呼吸暂停(OSA)且体重指数(BMI)≥30 kg/m2的成人患者的单一干预药物治疗。值得一提的是,礼来去年十月份已使用优先审评券向FDA递交Tirzepatide用于每周1次皮下注射给药治疗血糖控制不佳的2型糖尿病的新药上市申请(BLA)。Tirzepatide的适应症开发已涉及糖尿病、肥胖症、肾病(CKD)和OSA。
3.武汉睿健iPSC疗法报帕金森临床。武汉睿健医药帕金森研发管线NouvNeu001的临床试验申请获CDE受理。临床前数据显示,通过睿健医药自研的高效化学小分子诱导功能细胞(iPSC)再生技术,NouvNeu001移植入体内后可高效转化为成熟多巴胺能神经元,分泌多巴胺递质,并与体内原有神经元形成神经连接,产生综合性的治疗功能,改善帕金森症状。NouvNeu001也是同类产品国内首家申报临床。
4.慧渡医疗液态活检技术头对头研究结果积极。慧渡医疗的600基因PredicineATLAS™新一代液态活检技术在百时美施贵宝开展的大panel头对头检测试验中获积极结果。该研究评估5款国际领先的大panel液态活检产品用于检测模拟来自实体瘤的cfDNA样本和来自髓系肿瘤的plasma样本的灵敏度和特异性。当基因突变丰度(VAF)为0.125%时,与其他四种产品相比,慧渡医疗600基因PredicineATLAS™检测实体瘤(>95%)和髓系肿瘤(100%)的灵敏度均为最佳,而且所有测评条件下均未发生 “假阳性”。BMS在线发表PLOS ONE文章分享该项研究成果。
5.豪森引进小分子HIF-2α抑制剂。翰森制药旗下翰森(上海)健康及江苏豪森药业与NiKang公司就后者临床早期的小分子HIF-2α抑制剂NKT2152达成独家许可协议。NKT2152正被开发用于治疗晚期透明细胞肾细胞癌(ccRCC)患者。根据协议,NiKang将获得1500万美元首付款及最多2.03亿美元的开发、注册及基于销售的商业化里程碑潜在付款,以及基于净销售额的分级特许权使用费。翰森将拥有NKT2152在中国(包括香港、澳门及台湾)开发及商业化授权。
6.和黄医药索凡替尼收到FDA完整回复函。和黄医药日前宣布,FDA已针对索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤的新药上市申请发出完整回复函。FDA认为基于两项中国III期研究以及一项美国桥接研究的数据包尚不足以支持药品在美国获批上市;需要纳入更多代表美国患者人群的国际多中心临床试验(MRCT)来支持美国获批。索凡替尼是一种具有抗血管生成和免疫调节双重活性的口服抑制剂。
国际药讯
1.阿斯利康/第一三共ADC获FDA扩展适应症。FDA批准阿斯利康与第一三共联合开发的HER2-ADC新药Enhertu(trastuzumab deruxtecan)扩展适应症,用于治疗无法切除或转移性HER2阳性乳腺癌经治患者。在关键Ⅲ期临床DESTINY-Breast03中,与活性对照组相比,Enhertu二线治疗使疾病进展或死亡风险降低72%([HR]=0.28;95% CI:0.22-0.37)。根据BICR的评估,Enhertu治疗组的中位无进展生存期(PFS)尚未达到(95% CI: 18.5-NE),而活性对照组为6.8个月(95% CI: 5.6-8.2)。
2.艾伯维JAK抑制剂获批治疗AS。FDA批准艾伯维JAK抑制剂Rinvoq(upadacitinib)用于治疗对TNF阻滞剂反应不充分或不耐受的活动性强直性脊柱炎(AS)成人患者。此次批准是该药自去年12月来获批银屑病关节炎、特应性皮炎和溃疡性结肠炎适应症后的第4项批准。Rinvoq最初于2019年被批准用于治疗类风湿关节炎。根据艾伯维一季度报,Rinvoq销售额为4.65亿美元,较去年同期增长57%。
3.创新P-CAB根除幽门螺杆菌感染获FDA批准。Phathom公司新型钾离子竞争性酸阻滞剂(P-CAB)伏诺拉生获FDA批准上市,与阿莫西林和克拉霉素构成Voquezna Triple Pak方案,以及与阿莫西林构成Voquezna Dual Pak方案,用于治疗成人幽门螺杆菌感染。在关键Ⅲ期临床中,与兰索拉唑三重组合疗法相比,伏诺拉生三重和双重组合疗法的根除率均达到非劣效性标准,在mITT患者中,阳性对照组的根除率为78.8%,伏诺拉生三重组合和双重组合的根除率分别为84.7%和78.5%。
4.阿斯利康PD-L1抑制剂获FDA优先审评资格。阿斯利康PD-L1抑制剂度伐利尤单抗(Imfinzi)的补充生物制品许可申请(sBLA)获FDA授予优先审评资格,联合标准化疗治疗局部晚期或转移性胆道癌(BTC)患者。FDA有望在今年第三季度做出回复。在一项Ⅲ期临床TOPAZ-1中,与化疗相比,这一组合使患者死亡风险降低20%(HR=0.80, 95% CI,0.66-0.97, p=0.021);两组两年期总生存率为25%和10%。
5.拜耳Nubeqa新适应症获FDA优先审查。FDA受理拜耳口服雄激素受体抑制剂Nubeqa(darolutamide,达罗他胺)的一项补充新药申请,联合化疗治疗转移性激素敏感性前列腺癌(mHSPC)患者。在一项关键Ⅲ期ARASENS试验中,与雄激素剥夺疗法(ADT)+多西紫杉醇相比,Nubeqa+ADT+多西紫杉醇治疗组患者的总生存期(OS)有统计学上的显著改善、死亡风险显著降低32.5%。
6.吉利德购入NK细胞项目。吉利德科学与Dragonfly公司就后者临床前期的5T4-NK细胞项目DF7001达成合作许可协议。DF7001拟开发用于治疗癌症或炎症性疾病。根据协议,Dragonfly将获得3亿美元预付款,监管、开发和商业里程碑潜在付款,以及产品销售额20%的特许权使用费;吉利德将保留所有许可权,在临床前研究结束后,公司将获得Dragonfly股票的期权。DF7001的IND申请预计在 2023 年上半年提交。
7.辉瑞新冠口服药暴露后预防临床失败。辉瑞新冠口服药Paxlovid用于暴露后预防的II/III期临床(EPIC-PEP)结果未达主要研究终点。与安慰剂相比,接受Paxlovid 5天和10天治疗的成人感染风险分别降低32%和37%,无统计学意义,未能降低通过家庭接触暴露于新冠病毒的成人感染(确诊)的风险。安全性方面,与此前进行的临床试验基本一致。所有次要终点和亚组的分析正在进行中。
医药热点
1.安徽医科大学新校区建设项目启动。为加快安徽省医学教育创新发展,提升高水平医学人才和优质医疗服务资源供给能力,安徽医科大学日前启动新医科中心(新校区)项目建设。该项目为安徽省“十四五”规划教育提质扩容重大工程,将于“十四五”期间完成一期项目55.2万平方米建设。项目位于合肥市肥西县产城融合示范区,规划总用地面积2137亩,总建筑面积97万平方米,预计容纳学生2.3万人。
2.3位院士新任职华中科技大学。近日,华中科技大学在同济医学院干部教师大会上宣布,陈建国同志兼任同济医学院党委书记,聘陈孝平院士任同济医学院名誉院长、马丁院士任同济医学院医学学科建设委员会主任、邬堂春院士任同济医学院院长。据公开信息,陈孝平院士为肝胆外科学家,长期从事肝癌外科治疗和肝移植方面研究;马丁院士为妇产科学专家,擅长妇科肿瘤及妇科疾病的诊断和治疗;邬堂春院士为职业卫生与环境卫生学家,长期从事空气污染与健康的研究。
3.石家庄:新冠自测阳性经确认后将奖励1000元。为鼓励市民积极防疫、主动作为,石家庄市疫情防控总指挥部办公室日前发布《关于切实做好公民健康监测和个人防护》通告指出,对采用抗原试剂盒自我检测发现的阳性人员,经县(市、区)复检确认后,一次性给予1000元的奖励。
评审动态
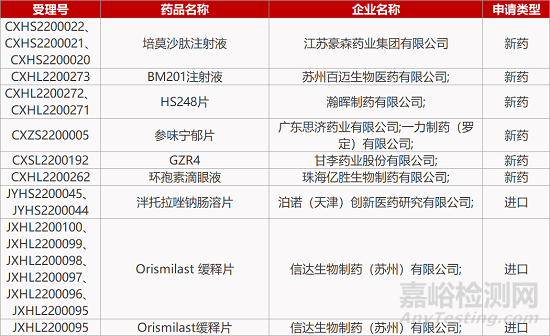
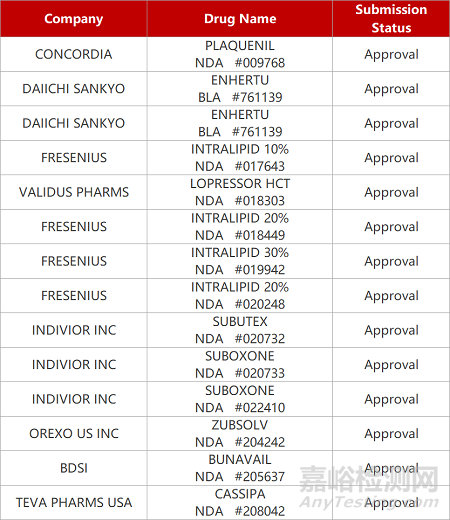

来源:药研发


