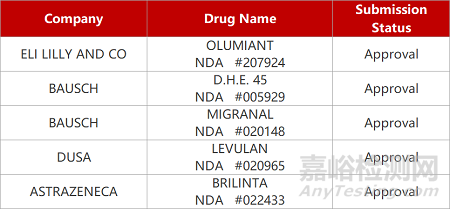
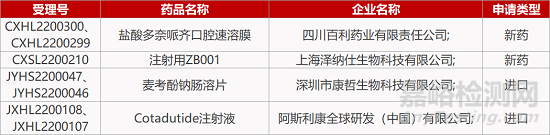
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
歌礼PD-L1单抗获批HIV临床。歌礼制药皮下注射PD-L1单抗ASC22(恩沃利单抗)获FDA批准,即将在美国开展用于人类免疫缺陷病毒1型(HIV-1)感染者免疫重建/功能性治愈的I/II期临床,评估ASC22在接受抗逆转录病毒疗法的HIV感染者中的安全性、有效性和药代动力学特征。此前,恩沃利单抗已获FDA批准开展用于慢性乙型肝炎功能性治愈的临床研究。
1.绿叶新冠中和抗体对Omicron有效。绿叶制药旗下博安生物自主研发的治疗COVID-19的第二代广谱中和抗体BA7208最新研究数据积极。体外假病毒中和试验数据显示:BA7208对于包括Alpha、Beta、Delta、Gamma、Lambda、Omicron等11种病毒变异均保持较高的中和活性,其中对Omicron亚型变异株BA.1和BA.2的IC50值达到2-5ng/mL。此外,BA7208对新出现的BA.3、BA.4、BA.5和BA.2.12.1亦能保持高中和活性。
2.科济CAR-T实体瘤临床见刊Nature子刊。科济药业CLDN18.2靶向CAR-T产品CT041治疗实体瘤的Ⅰ期临床积极结果发表在Nature Medicine上。CT041在消化系统肿瘤患者中的客观缓解率(ORR)达到48.6%,疾病控制率(DCR)为73.0%,在胃癌患者中ORR和DCR分别达到57.1%和75.0%;CT041整体耐受性良好,在输注后的28天内未发生剂量限制性毒性,未发生≥3级细胞因子释放综合征,未发生神经毒性综合征,无治疗相关死亡事件。
3.辉瑞GDF15单抗在华报IND。辉瑞1类生物制品Ponsegromab注射液的临床试验申请获CDE受理。这是国内首款申报临床的GDF15单抗,目前主要开发用于治疗癌性恶病质。癌性恶病质是一种主要由肿瘤细胞产物及机体释放的细胞因子引起的以全身代谢紊乱为特征的继发性反应,约20%的癌症患者死因与癌性恶病质有关。在Ib期临床中,它可将患者体内循环的GDF15水平降低至与健康人群相同。
4.君实CD3/CD20双抗报IND。君实生物自主研发的治疗用1类生物制品JS203的临床试验申请获CDE受理。JS203是一款重组人源化抗CD20和CD3双特异性抗体,通过联结并活化T细胞(结合CD3)和淋巴瘤细胞(结合CD20),可有效促进T细胞杀伤淋巴瘤细胞,拟开发用于复发难治B细胞非霍奇金淋巴瘤的治疗。在临床前研究中,JS203具有显著的抑瘤效果,而且耐受性良好。
5.百利药业HER2-ADC报IND 。百利药业1类生物药BL-M07D1注射液的临床试验申请获NMPA受理。BL-M07D1为一款靶向HER2的抗体偶联药物(ADC),是百利药业申报临床的第3款ADC新药。此前,百利药业已经申报EGFR/HER3双抗ADC和Trop2 ADC。目前EGFR/HER3双抗ADC(SI-B001)已获CDE批准开展七项临床试验,涉及的适应症包括头颈鳞癌(非鼻咽癌)、食管鳞状细胞癌、消化系统恶性肿瘤(结直肠癌、胃癌)和非小细胞肺癌。
6.箕星引进Hovione公司眼科项目。箕星药业与喷雾干燥领域药物公司Hovione就后者临床前期的眼科项目JX08达成独家许可协议。根据协议,箕星将获得JX08的全球权利,并领导从临床前到商业化阶段的全生命周期开发。此次合作进一步在老视和干眼疾病领域基础上增强箕星的眼科产品管线,也标志着箕星发展将从一家临床后期生物技术公司发展为一个拥有全生命周期开发能力的生物制药公司。
国际药讯
1.ROS1/NTRK抑制剂再获突破性疗法认定。Turning Point公司开发的ROS1/NTRK抑制剂repotrectinib获FDA授予突破性疗法认定,用于治疗ROS1阳性转移性非小细胞肺癌(NSCLC)。在一项Ⅰ/Ⅱ期临床中,在既往接受过1种ROS1抑制剂治疗、并且没有接受过化疗的ROS1阳性晚期NSCLC患者(n=56)中,repotrectinib达到36%的确认客观缓解率。此前FDA已授予该新药治疗携带NTRK基因融合的晚期实体瘤的突破性疗法认定。再鼎医药拥有repotrectinib在中国独家开发和商业化权益。
2.体内碱基编辑疗法即将步入临床。Verve公司碱基编辑疗法VERVE-101获新西兰监管机构批准,即将在杂合子家族性高胆固醇血症患者中开展首个人体临床试验。VERVE-101是一款通过在体内对PCSK9基因进行单碱基编辑,降低PCSK9表达和低密度脂蛋白胆固醇(LDL-C)水平的基因编辑疗法。它有望通过一次性治疗,永久降低患者心血管疾病的发作风险。在临床前研究中,单次VERVE-101输注一年后将PCSK9水平降低89%,将LDL-C水平降低68%。
3.暴食症在研药物II期临床失败。Idorsia公司开发的高脑透性、选择性食欲素1型受体拮抗剂ACT-539313,在治疗中重度暴食症的II期试验未能达到主要终点。与安慰剂相比,ACT-539313治疗组12周时患者每周暴食天数与基线的变化未能击败安慰剂。该新药总体耐受性良好。试验评估的其他因素还包括ACT-539313在调节患者行为特征方面的作用。Idorsia公司表示将放弃ACT-539313用于治疗暴食症的临床开发。
4.罗氏PD-L1+TIGIT组合III期临床失败。罗氏制药宣布,TIGIT抗体tiragolumab联合PD-L1单抗Tecentriq(阿替利珠单抗)对比Tecentriq单药一线治疗PD-L1高表达局部晚期或转移性非小细胞肺癌(NSCLC)患者的III期SKYSCRAPER-01研究未达到无进展生存期(PFS)的共同主要终点。在中期分析中,另一个共同主要终点总生存期(OS)尚未成熟。联合治疗耐受性良好,未发现新的安全信号。
5.辉瑞116亿美元收购Biohaven公司。辉瑞与Biohaven公司达成收购协议,交易金额总计约116亿美元。通过收购Biohaven,辉瑞将获得该公司的降钙素基因相关肽(CGRP)项目,包括已获FDA批准用于急性治疗和预防性治疗成人偏头痛的rimegepant(Nurtec ODT);拟用于偏头痛的急性鼻内喷雾治疗、并正在开发作为口服软胶囊用于预防慢性偏头痛的在研项目zavegepant;以及5个靶向CGRP的临床前项目。
1.超强变异新冠毒株BA.2.12.1登陆韩国。据韩国《中央日报》10日报道,韩国新增5例奥密克戎BA.2.12.1变异株感染病例,截至目前已累计报告6例该变异毒株感染病例,均为美国输入病例。奥密克戎BA.2.12.1变异毒株为奥密克戎BA.2亚型毒株的变异体,去年12月首次在美国被发现。据悉,BA.2.12.1变异毒株的传染性比现有的奥密克戎毒株高30%,甚至比传播速度最快的BA.2亚型毒株还要高20%左右。
2.中国取消清零,或致155万人死亡。2022年5月10日,复旦大学余宏杰团队在国际期刊Nature Medicine上发表题为“Modeling transmission of SARS-CoV-2 Omicron in China”的研究论文。这项建模研究显示,如果中国取消当前的动态清零政策,可能会引发大量奥密克戎感染,造成约155万人死亡,对重症监护(ICU)的需求量也将升至现有床位15.6倍。
3.全国护理发展五年规划出台。国家卫健委印发《全国护理事业发展规划(2021-2025年)》。《规划》要求,要采取有效措施增加护士队伍数量,特别是从事老年护理、儿科护理、中医护理、社区护理、传染病护理和安宁疗护工作的相关紧缺护理专业护士以及在基层医疗机构工作的护士数量。力争到2025年,全国护士总数达到550万人,每千人口注册护士数达到3.8人。