您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-12 13:25
医疗器械分类界定
1. 医疗器械分类管理
中国对医疗器械产品按照风险程序将其分为三类(即I类、II类和III类医疗器械),实行分类管理,不同类别的医疗器械产品,其注册、备案、许可程序及要求也不一样, 因此在医疗器械注册及相关许可申请之前确定产品分类是非常关键的。
I类医疗器械:风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
II类医疗器械:具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
III类医疗器械:具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
医疗器械分类的确定需要考虑产品的预期用途、结构特征和使用方法,并依据医疗器械分类规则、分类目录及现有产品标准等进行判定,必要时也可以申请分类界定申请,食品药品监督管理部门将组织专家对提交申请的产品进行分析并归类。
2. 分类界定
|
|
|
|
|
产品分析 |
1. 产品中文名称、预期用途、结构特征、使用方法等的法规符合性审核 |
电话或邮件咨询、培训,并提供《法规符合性审核报告》 |
|
分类确认 |
明确医疗器械的管理类别及注册要求 |
《医疗器械分类确认报告》 |
|
分类界定申请(可选) |
向CFDA申请分类界定(通过“医疗器械分类界定信息系统在线提交)——适用于新产品 |
《医疗器械分类界定报告》 |
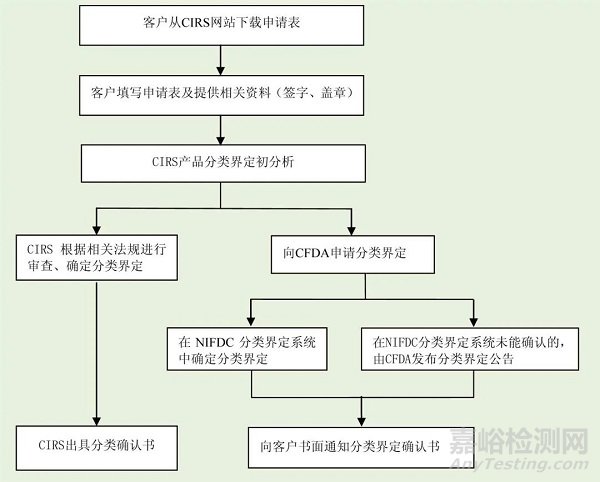
3. 服务流程
下载“医疗器械分类确认申请表”
根据要求填写申请表并及时反馈
根据企业提供的产品信息进行预分析,并向企业确认分类界定需求
根据企业提供的产品信息,并根据相关法规进行审查,最终确定产品分类,向企业发送书面的“医疗器械分类报告”
向CFDA申请产品分类界定,并跟踪分类界定结果,及时向企业发送书面的“医疗器械分类界定报告”

来源:Internet


