您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-15 10:34
一场新冠疫情,摧残了很多传统行业,也诞生了很多大健康行业,正如笔者一直所说的,医疗器械行业如“八九点钟的太阳,朝气而易被朝霞渲染……”越是天灾人祸的时候,医械行业越兴旺,所以,无论你在哪一个城市,都可以看到各种诱人的生物医药产业激励政策、各种生物医药产业园在孵化……
下面,笔者就简单的罗列一下医疗器械创业与注册上市流程。
产品战略
1.市场
企业是以销售产品获取赢利为目的的,所以,首先要问市场,能够被市场接受的,有需求的,有利润空间的产品就是好产品。
2.要关注国家政策趋向和市场动态变化趋向
随着国家大健康产业布局的展开,人们日益增长的健康需求与相较滞后的产品供给是大健康生态的主要矛盾,骨科、康复、人工智能、可移动家用、病理等方向市场空间巨大。其次应重点关注国家医疗政策、医保政策,作为医疗器械企业产品战略方向应契合国家医政、医保等政策方向,个人认为对于初创型企业或中小型企业在布局产品方向时应重点关注这些领域。
3.需要充分调研市场再最终确定
建议在立项前应征求临床医生和专业经销商的意见,以便获得真实客观的可行性依据,以避免因为单纯听取相对片面的意见而导致后期出现各种问题。
资金投入
医疗器械产业同样属于产业经济,医疗器械同样属于商品,这是商业固有的属性,但医疗器械属于特殊的商品,医疗器械产业属于特殊的产业,这属于商业的两重性。所以投资医疗器械产业有风险,不像其他传统制造业,如机械五金、服装鞋帽,租一片场地、搭个铁皮厂房、鼓捣几台机器、挽起袖子就可以大张旗鼓的干起来……..医疗器械一旦你选定了场地、建设了厂房,基本很难来一场 “说走就走的潇洒”……..
所以医疗器械的投资是一笔大投资、是一笔长远规划的投资、是一笔高准入的行业投资、是我等百姓望尘莫及的投资…….
公司注册
确定了公司住所后,就可以向当地市场监管局工商注册了,现在基本上是网上一次搞定、零跑腿,像广州这边还提供创业伴随服务。
厂房建设
确定了厂房地点之后,公司也注册了,接下来需要进行的就是厂房布局规划和设计施工了。无论是租赁厂房还是自建厂房,厂房建设的关注点是:第一合规、第二满足你的工艺需求、第三成本。
洁净厂房的建设一定要注意的以下几点,避免掉“坑”:
一是厂房设计,一定得找具备医药工业厂房设计资质或经验的设计单位设计。现在洁净厂房建设施工方大都是土木工程施工出身,盖楼建大厦是一流的,但他们大多不熟悉医药工业厂房设计的标准要求,也不熟悉你的产品工艺,所以他们给你出的图纸一般都是经验性的或者哪种方便那种来,亦或哪种施工方便、工期短哪种先来。
二是图纸一定得请专业人员审核。避免因设计不科学造成后续的整改。
三是施工过程须有专人跟进、验收。
质量管理体系建立
洁净厂房验收合格后,应着手质量管理体系的建立了,这时将陆续招聘团队人员了。质量管理体系的建立应有具备医疗器械行业经验人员根据公司未来产品方向进行统筹负责。质量管理体系建立遵行的准则为《ISO13485:2016 医疗器械 质量管理体系 用于法规的要求》、《医疗器械生产质量管理规范》及相应附录。但不是所有公司的质量管理体系都是千篇一律的,质量管理体系应结合公司组织结构、运作流程、产品特点进行统筹制定。
产品设计开发
产品设计开发的过程包括立项、设计开发输入、设计开发输出、设计开发验证、设计开发确认、设计开发转换以及贯穿于这些过程的评审、批准和更改。详见图1:设计开发流程。
笔者曾经在一场交流沙龙上有业内同行问道:“是先建立质量管理体系还是先设计开发输出后再建立质量管理体系?”这个问题有点像“先有鸡后有蛋”的问题,不过我可以肯定是,任何产品的设计开发必须在质量管理体系的流程下执行,从这种意义上来讲,应先有质量管理体系有关设计开发的流程性文件,然后执行设计开发流程输出产品有关质量管理体系文件,这样既符合逻辑又符合实际。
而事实上很多医疗器械企业是先进行产品开发,然后去建立质量管理体系,最后的结果就是产品是很有创新的“点子”,最后注册上市是路漫漫而求索……
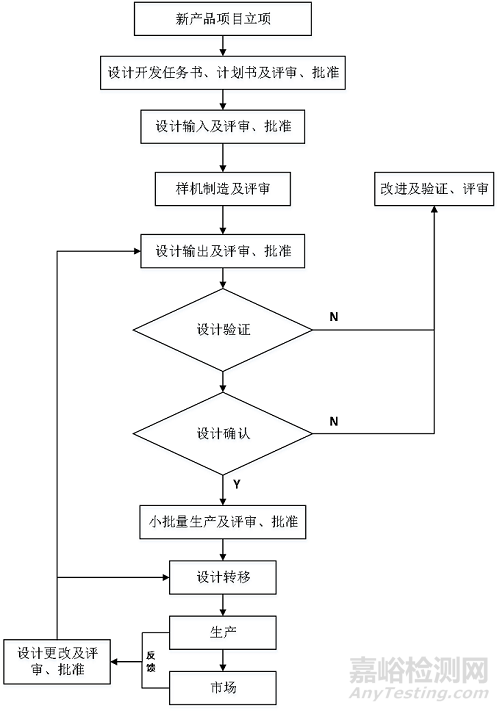
图1:设计开发流程
医疗器械注册上市流程
医疗器械注册是在现行有效的法规、标准情况下,按照医疗器械注册管理办法的要求进行申报的一项行政审批事项,整个行政审批事项遵循医疗器械法律法规和产品相关标准要求。
目前按照注册申报项目周期计算,一个二类免临床的产品平均周期需要14-15个月,没错,你没有听错,很多第三方咨询机构给你承诺的半年或三个月拿证,那是对市场极不负责任的商业行为。笔者现在给你捋一捋项目各个阶段的周期:
第一阶段:质量管理体系建立、运行:至少3个月(可和设计开发并行)
第二阶段:设计开发、注册检验:目前根据各省医器械所检验周期至少5个月,期间未产生补检的情况。
第三阶段:注册质量管理体系核查及整改:至少2个月。
第四阶段:技术审评发补:根据发补问题的复杂程度,不存在补检的情况下至少4个月,如发补需要补检,无论补检项目难易程度,至少6个月。
第五阶段:二次技术审评:至少1个月
第六阶段:行政审批、制证:至少1个月。
如此算来,一个二类免临床产品,平均周期需要14-15个月。

来源:Internet


