您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-13 11:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
上海璧辰可入脑MEK抑制剂获批临床。璧辰医药MEK1/2抑制剂ABM-168获FDA临床许可,拟开展Ⅰ期临床评估用于晚期实体瘤(特别是并发脑转移或原发性脑瘤)患者的安全性、耐受性、药代动力学以及初步抗肿瘤活性。ABM-168可阻断RAS和RAF突变或信号放大导致的细胞癌变信号通路,进而控制癌细胞生长。该新药已在临床前研究中显示出优越的血脑屏障参透性,单独使用或联合使用具有良好的抗肿瘤活性。
国内药讯
1.盛世泰科DPP-4抑制剂降糖Ⅲ期临床积极。盛世泰科DPP-4抑制剂盛格列汀治疗2型糖尿病的Ⅲ期临床达到主要临床终点。盛格列汀片50mg剂量组(低剂量组)第24周末糖化血红蛋白(HbA1c)降低值显著优于对照组。之后28周的盛格列汀100mg剂量组(高剂量组)还显示出良好的药物安全性,不良反应发生率与安慰剂组相似。该公司计划尽快向国家药监局提交盛格列汀的新药上市申请。
2.合源CD19靶向CAR-T白血病临床积极。合源生物靶向CD19的CAR-T产品赫基仑赛注射液(CNCT19,Inaticabtagene Autoleucel)在治疗成人复发或难治性急性B淋巴细胞白血病(r/r B-ALL)的关键临床研究达到主要疗效终点(IRC评估的3个月时的总体缓解率)。而且安全性良好。该公司计划近期向CDE递交CNCT19的新药上市申请。此前,该新药已获得CDE纳入突破性治疗药物,并被FDA授予孤儿药资格。
3.河南真实长效艾滋病新药获批临床。真实生物新一代长效HIV候选药物CL-197胶囊获国家药监局临床默示许可,拟开发用于治疗HIV-1感染的成年患者。CL-197是一种新型核苷逆转录酶抑制剂,可通过模拟(即与之竞争)内源性嘌呤核苷酸来抑制逆转录,在HIV感染治疗中具有潜在长效作用。临床前研究显示,CL-197能够有效抑制HIV的复制,有望成为每周仅需口服一次的长效艾滋病治疗药物。
4.以明生物与百济神州达成临床研究合作。以明生物宣布与百济神州达成临床合作与供应协议,旨在中国开展的临床研究中评估FIC髓系检查点抑制剂(IO-108和IO-202)与百济神州PD-1替雷利珠单抗联合用药的效果。IO-202是一款LILRB4抗体,正在美国开展两项I期临床,已获得FDA授予的用于治疗复发或难治性急性髓系白血病(AML)快速通道资格。IO-108是一款LILRB2抗体,正在美国开展Ⅰ期临床(NCT05054348),截至目前,IO-108单药或与帕博利珠单抗联用,均表现出良好耐药性。
5.石药购进和铂FcRn单抗大中华区权益。和铂医药与石药集团全资子公司恩必普药业达成转让协议,恩必普药业将获得前者从HanAll公司引进、拟用于全身型重症肌无力的FcRn单抗巴托利单抗(HBM9161)在大中华区(包括中国大陆、香港、澳门及台湾)开发、制造及商业化的独家权益。HBM9161已被CDE纳入突破性治疗品种,是国内首个进入临床的新型FcRn单抗。这项交易最高达人民币10亿元。
国际药讯
6.神经科学精准疗法公司完成新一轮融资。Neumora公司宣布完成1.12亿美元B轮融资,用以支持其针对神经心理障碍与神经退行性疾病的创新精准疗法的临床和临床前开发。该公司的先导项目κ阿片受体拮抗剂NMRA-140目前已完成Ⅱa期临床患者的招募工作,该试验拟评估NMRA-140用于抑郁症的治疗潜力。该公司临床阶段的项目还有用以治疗神经心理障碍的血管升压素1a受体拮抗剂NMRA-511,以及将于2023年进入Ⅰ期临床的M4毒蕈碱受体正向别构调节物NMRA-266。
医药热点
1.医保局:将继续加强医保药品支付管理。10月12日,国家医保局针对全国人大代表、齐鲁制药总裁李燕,以及全国人大代表、康恩贝董事长胡季强的两份建议作出回复。国家医保局表示:自2020年起各地开始按要求,陆续清退医保药品目录中的增补品种,预计到今年年底全国基本医保、大病保险和医疗救助的药品保障范围就能“基本统一”;各地如“探索医保创新支付”,既不符合改革发展方向,也不利于各地区间的“公平性、协调性”。
2.安徽拟建立互联网医疗服务监管平台。安徽省卫健委日前印发《安徽省互联网诊疗监管实施办法(试行)》,明确提到将建立安徽省互联网医疗服务监管平台对开展互联网诊疗活动的医疗机构进行监管。《办法》规定,医疗机构应当将开展互联网诊疗活动的医务人员信息上传至省级监管平台,包括身份证号码、照片、相关资质等必要信息,并及时更新完善;应根据依法执业、医疗质量、满意度等内容对医务人员进行考核并建立准入、退出机制;还应当保证互联网诊疗活动全程留痕、可追溯,并向省级监管平台开放数据接口。
3.新疆将家庭腹膜透析临时纳入医保。近日,新疆维吾尔自治区医疗保障局将家庭腹膜透析治疗指导(住院)、家庭腹膜透析自我治疗(门诊)、家庭巡诊,以及家庭腹膜透析自我治疗相关碘伏小帽(碘液微型盖)和管路等耗材临时纳入自治区和兵团基本医疗保险支付范围,以降低疫情防控期间尿毒症参保患者就医易感风险。家庭腹膜透析自我治疗及相关诊疗实行按部分支付诊疗项目管理。
评审动态
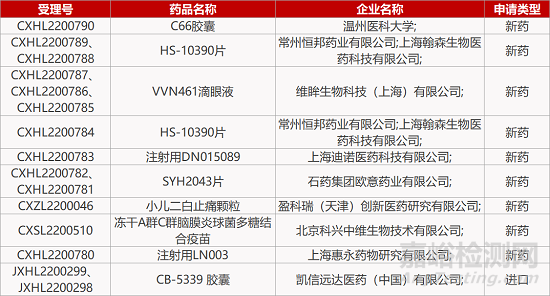
1. CDE新药受理情况(10月12日)

来源:药研发


