您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-14 11:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
荣昌泰它西普获重症肌无力孤儿药资格。荣昌生物全球首款BLyS/APRIL双靶点融合蛋白泰它西普(RC18, 泰爱®)获FDA授予孤儿药资格,用于重症肌无力(MG)的治疗。RC18通过抑制BLyS和APRIL两个细胞因子的过度表达,从而治疗B细胞介导的包括系统性红斑狼疮、重症肌无力适应症在内的多种自身免疫性疾病。今年上半年,泰它西普用于全身型重症肌无力(gMG)的国内II期临床已获得积极阳性结果。
国内药讯
1.基石RET抑制剂肺癌适应症报产。基石药业引进新药普拉替尼的新适应症上市申请获CDE受理,推测适应症为一线治疗局部晚期或转移性RET融合阳性非小细胞肺癌患者。在一项国际I/II期临床ARROW研究中,普拉替尼在初治患者中达到79%(95%CI:68%-88%)的总缓解率。普拉替尼已于2021年3月获NMPA批准上市,是中国首个获批的RET抑制剂。
2.百济神州BTK抑制剂淋巴瘤Ⅲ期临床成功。百济神州宣布,BTK抑制剂泽布替尼(百悦泽)对比伊布替尼用于治疗既往经治的复发或难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的国际Ⅲ期临床ALPINE终期结果积极。经独立评审委员会(IRC)及研究者评估,泽布替尼在无进展生存期和总缓解率方面较伊布替尼具有优效性;药物的总体耐受性良好,其安全性结果与既往报告中一致。目前泽布替尼用于上述适应症的监管申请正接受FDA的审评,有望明年初获得回复。
3.育源生命引进FIC生殖新药获批临床。ObsEva公司催产素受体拮抗剂nolasiban分散片获国家药监局临床默示许可,拟开发用于改善胚胎移植前子宫内膜收缩波异常的体外受精/卵细胞浆内精子注射(IVF/ICSI)患者的临床妊娠率。nolasiban是全球生殖领域近20年来第一款潜在“first-in-class”药物,育源生命拥有该新药在中国的开发和商业化权利。在ObsEva公司开展的临床IMPLANT 2研究中,与安慰剂相比,nolasiban组胚胎移植10周后的受试者怀孕率更高(35.6%vs28.5%)。
4.中生尚健PD-L1/VEGF双抗获批临床。中生尚健自主研发的靶向PD-L1/VEGF双抗新药“注射用SG1408”获国家药监局临床试验默示许可,拟开发用于晚期恶性实体瘤的治疗。SG1408能同时特异性结合PD-L1和VEGF,其抗肿瘤作用明确。在临床前研究中,SG1408显示出可发挥“1+1>2”的协同效应的潜力,且安全性良好。中生尚健是杭州尚健生物和中国生物合资成立的新药研发公司,该公司目前已完成超2亿元人民币的B+轮融资。
5.驯鹿生物授权CD19序列开发自免疗法。驯鹿生物与Cabaletta Bio公司达成合作许可协议,共同开发和商业化CD19靶向CAR-T候选产品CABA-201,以用于自身免疫性疾病的治疗。根据协议,Cabaletta将在靶向CD19的CAR-T候选产品CABA-201中使用驯鹿生物开发的、经临床验证的全人源CD19序列;驯鹿生物将有资格获得最多两款产品,还有累计约为1.62亿美元的首付款以及潜在开发和商业化里程碑付款和销售分成。驯鹿生物拥有合作产品在大中华区开发和商品化的优先权。
国际药讯
1.FDA扩大两款新冠二价疫苗适用人群。FDA宣布,已修订Moderna、辉瑞/BioNTech二价新冠疫苗的紧急使用授权,授权其在较年轻群体中作为单剂加强针,在基础免疫或加强免疫至少两个月后使用。其中,Moderna的二价新冠mRNA疫苗(mRNA-1273.222)被授权用于6至17岁儿童的加强针。辉瑞/BioNTech的二价新冠疫苗被授权用于5至11岁儿童的加强针。此外,辉瑞/BioNTech 的单价新冠疫苗将不再被授权作为5至11岁年龄组的加强针。
2.罗氏口服SMA疗法长期疗效积极。罗氏口服脊髓性肌萎缩症(SMA)疗法利司扑兰(Evrysdi)在6月龄至60岁SMA经治患者中开展的JEWELFISH研究获最新积极数据。该项研究结果显示,在治疗4周后,Evrysdi组患者的中位SMN蛋白水平较基线提高2倍,改善的SMN蛋白表达可持续2年多。通过探索性疗效终点观察,患者的运动功能在2年期间得以维持。长期的安全性数据与之前披露一致,研究中止率较低。
3.罕见肝病新药III期临床成功。Albireo Pharma非系统性回肠胆汁酸转运抑制剂(IBATi)Bylvay(odevixibat)治疗Alagille综合征的III期ASSERT研究结果积极。该试验达到改善瘙痒的主要终点(p=0.002)和减少血清胆汁酸的关键次要终点(p=0.001)。而且药物的耐受性良好,总体不良事件发生率与安慰剂相似。Albireo计划立即向FDA和EMA提交该新药的上市申请。
4.非激素避孕产品获批开展III期临床。Daré Bioscience公司非激素避孕产品Ovaprene获FDA批准,拟开展关键性III期临床,评估Ovaprene作为避孕装置的有效性、安全性和可用性。Ovaprene是一款每月1次、阴道内使用且不需要在性交过程中使用的避孕产品,通过释放一种局部作用的葡萄糖酸亚铁来阻止精子运动,防止精子进入子宫颈管,从而起到避孕效果。如果获批,Ovaprene将成为首个月用非激素女性避孕产品。
5.TCR-Treg新药获批A型血友病临床许可。TeraImmune公司人凝血因子VIII(FVIII)靶向TCR-Treg产品TI-168的Ⅰ/Ⅱa期临床试验申请获FDA批准,拟评估用于患有血友病伴抑制物的先天性血友病A(HA)患者中的治疗作用。TI-168是TeraImmune自主研发的下一代FVIII特异性Treg疗法,旨在为FVIII抑制的血友病A患者提供有效且安全的治疗。在血友病动物模型中,该疗法已显示出控制FVIII抗药物抗体(ADA)的治疗潜力。
6.拜耳布局不可成药癌症靶点药物。拜耳旗下公司Vividion与Tavros Therapeutics达成战略性合作协议,将利用后者的下一代双向合成致死(bi-directional synthetic lethality)平台,结合Vividion专有的、可识别数百种之前未知的功能性“口袋”的化学蛋白组平台,共同开发靶向4个肿瘤学靶点的候选药物。根据协议,Tavros将获得1750万美元的预付款,约4.3亿美元的临床前、临床与商业开发里程碑潜在款项。此外,拜耳亦有权选择最多5个额外的靶点,并为此支付约4.8亿美元的资金。
7.Moderna与默沙东联合开发mRNA癌症疫苗组合。默沙东扩展与Moderna现有合作,选择与Moderna联合开发与商业化个体化癌症疫苗(PCV)mRNA-4157/V940。Moderna所开发的mRNA-4157/V940癌症疫苗可根据患者的肿瘤突变,刺激产生T细胞抗肿瘤反应。两家公司目前正在Ⅱ期临床KEYNOTE-942中评估mRNA-4157/V940与Keytruda联用治疗高风险黑色素瘤患者的潜力。根据协议,默沙东将支付Moderna约2.5亿美元资金。
医药热点
1.国家疾控局:不能以“静默”代替管控。10月13日,国家疾控局传防司司长雷正龙在国务院联防联控机制新闻发布会上表示,要不断提升疫情防控科学精准水平。要求各地加快精准流调,疫情防控不能简单化,不能过大范围划定风险区域,不能以“静默”代替管控。要及时精准划定中高风险区,及时采取坚决果断的管控措施,并根据疫情形势变化进行动态调整,符合解封条件的要及时解封,方便群众生活及出行。
2.上海一医院开设互联网疼痛病房。近日,同济大学附属上海市第四人民医院疼痛科创新开设互联网疼痛病房,一端连接着在家“住院”的患者,随身携带一套智能电子镇痛装置,另一端连接着医生、护士以及药剂师、康复师和营养师等。这种个性化的治疗模式,能够让医护人员在患者出院后,仍能提供及时和精准的治疗和护理,让广大疼痛患者居家镇痛成为现实。居家镇痛的主要适应证包括:中晚期癌性疼痛、带状疱疹神经痛、糖尿病或下肢动脉硬化闭塞症导致的缺血性神经痛等。
3.八月法定传染病死亡病例公布新冠0例。10月6日,中国疾病预防控制中心英文周报(CCDCWeekly)发布了8月份国家法定传染病病例和死亡病例。总体来说,因艾滋病死亡2106例,肺结核死亡365例,丙肝死亡45例,乙肝死亡26例,狂犬病死亡11例,梅毒死亡4例,流感死亡3例,新冠死亡0例。
评审动态

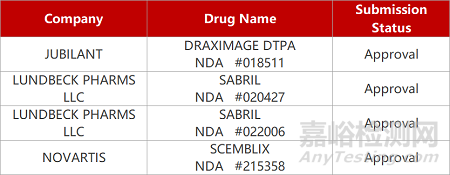

来源:药研发


