今日头条
贺普NTCP靶向新药获批肝炎临床。贺普药业1类化药贺普拉肽获国家药监局临床默示许可,拟开发用于丁型肝炎患者的治疗。贺普拉肽是一款针对钠-胆酸共转运蛋白(NTCP)靶点的全新药物,通过与NTCP特异性结合,阻断病毒对肝细胞的感染。目前,该公司正在II期临床中评估贺普拉肽联合干扰素用于乙肝的治疗潜力,预期今年年底可步入III期临床开发阶段。
国内药讯
1.博锐「托珠单抗」生物类似药报产。博锐生物旗下海正生物研发的托珠单抗注射液生物类似药(商品名:安佰欣)的上市申请获中CDE受理,用于治疗类风性湿关节炎、全身型幼年特发性关节炎和细胞因子释放综合征适应症。托珠单抗原研药由罗氏开发,商品名为雅美罗,是一款抗人白介素-6受体(IL-6R)单克隆抗体。此前,雅美罗已经在中国获批上述三项适应症。
2.诺诚健华BTK抑制剂Ⅱ期临床结果见刊。诺诚健华在《美国血液学杂志》上发表布鲁顿酪氨酸激酶(BTK)抑制剂奥布替尼(宜诺凯)治疗复发/难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的Ⅱ期临床研究成果。研究结果表明,IRC评估的总缓解率(ORR)为92.5%,完全缓解(CR)率为21.3%。研究者评估的ORR和CR率分别为93.8%和26.3%。中位无进展生存期(PFS)尚未达到,30个月PFS率和总生存(OS)率分别为70.9%和81.3%。
3.华辉安健启动新冠鼻喷剂II期临床。华辉安健自研鼻喷雾剂HH-120在clinicaltrials.gov网站上登记注册一项II期临床(NCT05713318),评估用于治疗轻度新冠病毒感染的疗效和安全性。HH-120是一种血管紧张素转换酶2(ACE2)Fc融合蛋白。该项研究计划纳入200例18岁以上的轻度新冠感染患者,预计年底可完成该项试验。目前全球仅有两款同类药物进入II期临床,评估用于新冠的治疗潜力。
4.威尚ATM抑制剂获FDA孤儿药资格。FDA授予威尚生物具有血脑屏障高穿透性的ATM靶向抑制剂WSD0628孤儿药资格,用于治疗恶性神经胶质瘤。WSD0628是非醛氧化酶底物,已在多种颅内PDX模型中联合放疗显著延长总生存期,拟开发联合放疗作为放疗增敏剂用于脑胶质母细胞瘤(GBM)、间变型胶质瘤(AA)以及其他肿瘤的神经中枢转移。
5.创响长效IL-36R抗体在美获批临床。创响生物新型IL-36R靶向单抗IMG-008获FDA批准Ⅰ期临床。IMG-008通过与人白介素36受体(IL-36R)结合,可阻断IL-36R下游信号传导和细胞因子释放。在临床前研究中,IMG-008的半衰期比另一款已上市IL-36R抗体的类似物长4倍以上,暴露量高2倍以上。IMG-008有望为泛发性脓疱性银屑病(GPP)和化脓性汗腺炎(HS)等多种炎症性疾病提供治疗方案。
国际药讯
1.达格列净获批用于全射血分数心衰患者。阿斯利康SGLT2抑制剂达格列净获欧盟批准,用于射血分数保留的心衰(HFpEF)。此次批准意味着达格列净的使用范围已覆盖整个左心室射血分数(LVEF)范围的患者,包括射血分数轻度降低型(HFrEF)和保留型心衰。两项Ⅲ期临床(DAPA-HF和DELIVER)汇总结果显示,无论患者LVEF值如何,Farxiga在中位追踪期为22个月时,可降低患者14%的心血管死亡风险(p=0.01,ARR 1.5%)。
2.Aldeyra公司FIC干眼症疗法报NDA。Aldeyra公司小分子RASP抑制剂reproxalap眼药水的新药申请(NDA)获FDA受理,这是一款潜在“first-in-class”新药,拟用于干眼症的治疗。FDA预计在2023年11月23日前完成审查。在Ⅲ期临床TRANQUILITY-2中,reproxalap可使患者在用药10分钟内快速缓解干眼症状;在干燥眼房(dry eye chamber)中的眼睛发红情形(P=0.0004)与Schirmer测试(P=0.0005)上,应答者比例均显著优于载体对照组。
3.拜耳阿柏西普长效给药方案报产。拜耳向欧洲药品管理局(EMA)提交其阿柏西普8mg制剂的上市申请,用于治疗新生血管(湿性)年龄相关性黄斑变性(nAMD)和糖尿病性黄斑水肿(DME)。在III期研究(PULSAR和PHOTON)中,与每8周给药一次的阿柏西普2mg相比,每12周或每16周一次的阿柏西普8mg在改善最佳矫正视力(BCVA)评分方面显示非劣性。2022年,阿柏西普销售额达到96.47亿美元,同比增长4%。
4.罗氏新一代C5补体抑制剂Ⅲ期临床积极。罗氏新一代C5循环抗体crovalimab治疗阵发性睡眠性血红蛋白尿症(PNH)患者的全球Ⅲ期COMMODORE 2研究结果积极。与标准治疗相比,crovalimab在既往未接受补体抑制剂治疗的PNH患者中实现疾病控制,达到避免输血和控制溶血的共同主要疗效终点。该新药此前已获CDE纳入优先审评品种名单,有望成为罗氏首款创新药物在中国获得全球首批。
5.溶瘤病毒组合疗法获融资进入Ⅱ期临床。TILT Biotherapeutics宣布完成2200万欧元的第二轮融资,以用于推进其武装溶瘤腺病毒TILT-123与免疫检查点抑制剂的组合疗法进入Ⅱ期临床。TILT-123能够在肿瘤内部复制,裂解肿瘤并释放肿瘤相关抗原产生免疫刺激细胞因子TNFα和IL-2。该公司计划评估TILT-123与默克/辉瑞PD-L1抑制剂Bavencio联合治疗头颈癌,以及评估TILT-123与默沙东PD-1抑制剂Keytruda联合治疗卵巢癌与难治性非小细胞肺癌的潜力。
6.PVR抗体联合K药开展实体瘤临床。Nectin Therapeutics公司抗PVR抗体NTX1088拟联合默沙东PD-1抗体Keytruda开展联合用药临床研究,评估组合治疗局部晚期和转移性实体瘤的有效性与安全性。NTX1088是一款靶向PVR(CD155)的潜在“first-in-class”抗体。PVR在肺癌、结直肠癌、肝癌、乳腺癌、胃癌等多种实体瘤中过度表达。PVR的高度表达与患者预后不良和PD-1/PD-L1抑制剂耐药性相关。
医药热点
1.上海市肺科医院开通线上自助入院。为进一步改善医疗服务,上海市肺科医院日前开通微信公众号线上自助办理入院登记项目。患者或家属只要关注“上海市肺科医院”公众号,动动手指便可轻松在线完成入院登记,减少在入院处排队等待的困扰。目前手机端自助入院功能仅适用于上海城保及居保患者、自费患者,其他患者可至自助机和人工窗口办理。
2.河北省拟每市至少建设5家互联网医院。近日,河北省发布《加快建设数字河北行动方案(2023-2027年)》,目标是到2027年,数字经济核心产业增加值达到3300亿元,数字经济占GDP比重达到42%以上,智慧医疗等新业态、新模式全面融入人民生产生活。《方案》指出,力争到2025年,每个设区的市至少建设5家互联网医院,并在二级以上医院全面推广5G智慧医疗应用。
3.2023年沃尔夫化学奖公布。以色列沃尔夫基金会(the Wolf Foundation)公布2023年沃尔夫奖(Wolf Prize)获奖名单,其中化学领域的奖项分别颁发给芝加哥大学何川(Chuan He)教授,日本东京大学Hiroaki Suga教授,以及美国斯克里普斯研究所Jeffery W. Kelly教授,以表彰他们揭示RNA和蛋白质的功能和病理性功能障碍,并创造了以新的方式利用这些生物聚合物的能力来改善人类疾病的策略。
评审动态
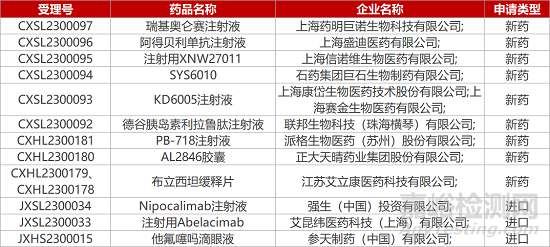
1. CDE新药受理情况(02月08日)
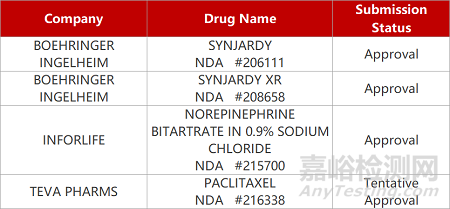
2. FDA新药获批情况(北美02月07日)