您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-11-27 08:26
一、原代细胞概述
指直接从活体组织或器官中分离并在体外培养的细胞,保留了与原组织相似的生物学特性和功能。这些细胞在培养中具有有限的增殖能力,但由于其高度的生理相关性,被广泛用于研究细胞生理、疾病机制以及药物筛选等领域。
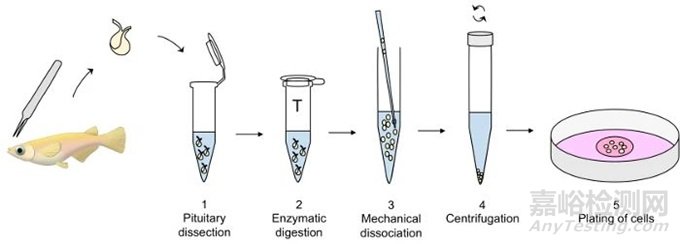
二、原代细胞分离
将细胞从组织或器官中提取并进行体外培养的过程。具体步骤包括在无菌条件下获取目标组织,利用酶如胰蛋白酶或胶原酶进行消化,将组织分解成单个细胞悬液,然后通过离心和过滤等方法分离出细胞,最终在适当的培养条件下进行培养。
三、实验步骤(消化培养法)
1、在无菌条件下,首先取大约1cm³的待培养组织,放入平皿或烧杯中,经过多次用适量的Hanks溶液冲洗,去除血液残留和结缔组织。
2、用锋利的剪刀将组织块剪碎,得到约0.5mm × 1mm大小的小块,并用Hanks溶液进行冲洗,使组织块沉淀并弃去洗液。
3、将组织小块吸入预先装有无菌磁力搅拌子的锥形烧杯中,加入15~30ml的胰蛋白酶,然后用橡皮塞盖紧,并用锡箔封好,置于37°C培养箱内的电磁搅拌器上。
4、打开搅拌器,启动搅拌子,关闭培养箱,使胰蛋白酶或胶原酶开始消化。在消化过程中,用显微镜观察,检查细胞是否分散成单个。若大多数细胞已分散,立即加入适量的Hanks溶液,终止消化。通常需10~20分钟消化。
4、先用100μm不锈钢筛过滤,滤去未消化的组织块或大细胞团,然后用20μm不锈钢筛过滤。
5、将滤液进行低速离心5分钟(500转),吸除上清液,并用Hanks溶液洗涤2次,最后加入含血清的培养液,摇匀,制成细胞悬液。
6、用计数板计数,确定细胞悬液的浓度,通常以1×105~3×105个细胞接种于培养皿中并放入培养箱(37摄氏度5%CO2)。
四、注意事项
1、组织块在进行消化前需要进行2-3次漂洗,以去除组织中的钙、镁离子和血清对胰蛋白酶和EDTA的抑制作用。
2、漂洗可使用Hanks溶液或其他适当的缓冲溶液,将组织块置于漂洗液中,轻轻摇动或轻轻搅拌,使其中的离子和抑制物质充分溶解和排出,然后将漂洗液弃去,准备进行下一步的消化处理。
3、胰蛋白酶是一种由胰脏分泌的消化酶其主要功能是水解蛋白质,将复杂的蛋白质分解为较小的多肽和氨基酸,这有助于身体吸收和利用蛋白质。胰蛋白酶主要作用于赖氨酸或精氨酸相连接的肽键,从而使蛋白质水解。
4、胶原酶则是一种来源于细菌的酶,在消化系统中具有强大的胶原水解作用。胶原酶能够有效地分解胶原蛋白,因此在医学上常被用于消化纤维性组织、上皮组织甚至癌组织。
5、适当提高原代培养接种的细胞密度,为培养细胞提供更多与体内相似的细胞间相互作用,可大大提高原代培养细胞在体外的存活率。

来源:实验老司机


