TGA对医疗器械监管的分类同样是依据产品的风险程度,产品的分类等级随着其风险的升高而递增。
二、医疗器械注册费用
计划将医疗器械产品投放TGA市场的制造商,都需要向TGA申请将产品纳入ARTG注册库中。在将产品纳入ARTG注册库过程中会涉及到注册费用和体系审核费用等。此外,与FDA类似,申办者还需要每年向TGA缴纳年费以维持产品在澳大利亚的合法销售。澳大利亚的财政年度是从当年的7月1日到第二年的6月30日。
已有产品在澳大利亚销售的制造商及申办者应在每个财年结束前确定需要继续在澳大利亚销售的产品并及时缴纳年费,不想继续在澳大利亚销售的产品则需要及时向TGA申请撤销,以免产生新的年费。
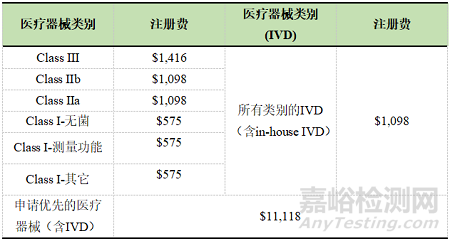
1. 申请ARTG的注册费用
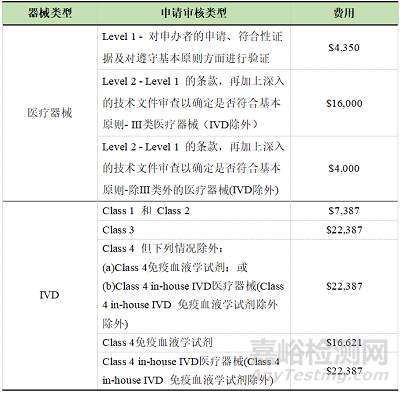
2. 医疗器械注册的体系审核费用
TGA的体系审核分三种情况:强制、豁免,自行选择。
强制审核的情况有:
★在性交时阴茎插入过程中作为避孕或预防疾病传播的屏障的器械(避孕套除外);
★植入式避孕的器械;
★脊柱融合植入式器械;
★专门用于为另一医疗器械消毒的器械;
★可植入的人工晶状体医疗器械;
★一种眼内粘弹性流体的医疗器械;
★未根据EC互认协议或EFTA互认协议进行评估的第3类医疗器械;
★用于监测第4类IVD医疗器械的非测定专用质量控制材料;
★用于自检的IVD医疗器械;
★用于护理点检测的IVD医疗器械;
★用于检测性传播因子存在或暴露于性传播因子的第3类IVD医疗器械;
★拟在药品福利计划下提供使用的IVD医疗器械;
★拟供国家筛选项目使用的IVD医疗器械;
★第4类IVD医疗器械;
★第4类in-house IVD医疗器械;
★伴随诊断医疗器械。
豁免审核的情况有:
★获得TGA合格评定证书;
★持有未被暂停或撤销的MDR或IVDR证书;
★被纳入ARTG作为仅限出口的医疗器械或IVD。
自行选择的情况指的是没有在强制审核列表中的医疗器械产品,申办者可以自行选择是否要求体系审核,并且无需支付审核费用。
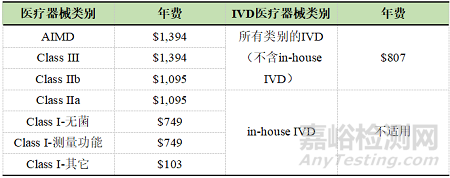
3. 医疗器械年费
TGA每年都会更新医疗器械年费,因此每年的年费会发生变化。下表是2023财政年度的年费。