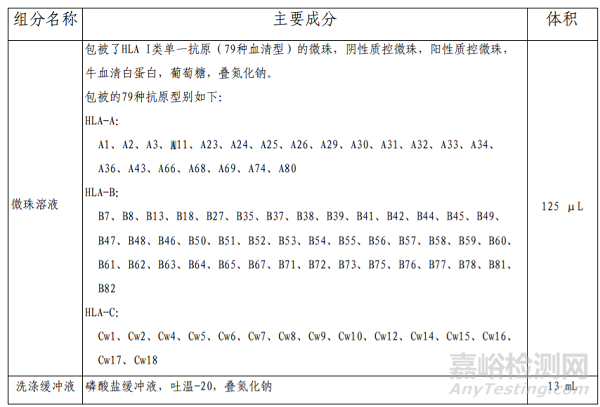
1、HLA I类单抗原特异性抗体检测试剂盒的主要组成成分
表1 主要组成成分
2、HLA I类单抗原特异性抗体检测试剂盒的产品预期用途
本产品用于体外定性检测血清样本中的HLA I类特异性IgG抗体。
本产品使用包被有纯化的I类HLA抗原的微珠和预先优化的试剂来检测人血清中的I类HLA抗体,可确认抗体特异性,以帮助移植供体受体匹配。
3、HLA I类单抗原特异性抗体检测试剂盒的检验原理
待测血清与微珠一同孵育。待测血清中存在的HLA抗体与微珠上的抗原相结合,然后使用藻红蛋白标记羊抗人IgG二抗进行标记。多功能流式点阵仪或多功能流式分析仪可以同时检测每个微珠上的藻红蛋白发射的荧光信号以及微珠染色编号,并可近乎实时获取数据。待测血清的反应模式与该批次抗原特异工作表进行比较,以确定HLA抗体的特异性。
4、HLA I类单抗原特异性抗体检测试剂盒的主要原材料
1)主要原材料的选择
本产品主要原材料包括微珠,HLA I 类抗原。其中HLA I类抗原为重组表达抗原。
微珠为外购,HLA I类抗原为自制。开发人制定了各主要原材料质量要求并经检验合格。
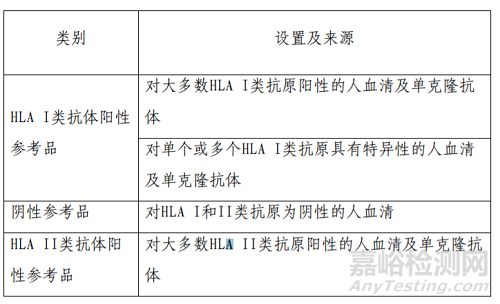
2)企业参考品和质控品设置情况
开发人设计了完整的企业参考品,包括HLA I类抗体阳性参考品,阴性参考品,HLA II类抗体阳性参考品。参考品采用临床样本和单克隆抗体制备而成,涵盖了本产品声称的所有79种HLA I类抗体血清型,其设置及来源见下表:
所有参考品中相关抗体的特异性采用已上市同类产品进行确认。各项企业参考品综合用于产品企业参考品符合性等性能评估,抗原原材料特异性验证以及内部质量控制。
5、HLA I类单抗原特异性抗体检测试剂盒的生产工艺及反应体系研究
开发人通过企业参考品检验等功能性试验确定最佳的生产工艺及反应体系,包括:抗原包被浓度,抗原包被孵育时间,洗涤缓冲液用量,微珠缓冲液用量,二抗用量,反应孵育条件及离心条件;同时通过检测临床样本确定最佳的样本用量以及微珠溶液用量。
6、HLA I类单抗原特异性抗体检测试剂盒的分析性能评估
本产品分析性能包括企业参考品符合性、准确度、精密度、最低检测限、特异性(交叉反应、干扰试验)、包容性。开发人开展了多批产品(010、011、012、013批)在适用机型上的性能评估。
1)企业参考品符合性
采用企业参考品,包括HLA I类抗体阳性参考品,阴性参考品,HLA II类抗体阳性参考品对本产品进行检验,结果均符合要求。
2)准确度
采用本产品与已上市同类产品(流式荧光免疫法)进行比较研究试验,共检测72份样本,样本涵盖本产品声称的所有HLA I类抗体的血清型。在三批产品两个机型的阳性符合率为90.73% -91.76%,阴性符合率为95.96% - 97.95%, 总符合率为94.91% -96.59%,表明两种方法具有较好的一致性。
3)精密度
采用经过其他方法验证或来自经认可的专业组织的14个参考样本,样本涵盖本产品声称的所有HLA I类抗体的血清型。在三个研究中心(One Lambda, Inc.、加州大学洛杉矶分校和 Terasaki 创新中心)的适用仪器上进行了测试。符合率为93.74% - 98.01%,结果表明试剂性能稳定。
4)最低检测限
选择了来自不同献血者的样本,这些样本几乎涵盖了该试剂可检测到的所有特异性抗体。在连续稀释后,对样本进行测试,并将稀释后的样本与未稀释(原)样本的结果进行比较,以评估总体一致性。考虑到原样本之间存在抗体水平/亲和力的差异,最低检测限定义为当一致性率>90%时的最大稀释因子。结果表明,当每个样本以 1:2 和1:4的比例稀释时,符合本产品可接受标准。
5)特异性
在交叉反应研究中,对含有HLA II类抗体,甲型流感抗体,水痘抗体,乙肝抗体,丙肝抗体,抗核抗体,抗双链DNA抗体,IL-6(促炎症)抗体,促甲状腺素抗体,乙酰胆碱受体抗体的样本进行交叉反应评价,结果表明本产品与上述样本均不产生交叉反应。
在干扰试验研究中,将以下可能产生干扰的内源及外源性物质加入每个待测样本中并与该样本的未处理形式进行比较,结果显示:样本中可能存在的内源性干扰物质白蛋白(15mg/mL),D-葡萄糖(9.9mg/mL),胆红素(0.2mg/mL),胆固醇(5.031mg/mL),肌酸酐(0.05mg/mL),血红蛋白(2mg/mL),在所示浓度时对本试剂不产生干扰;外源性饮食/药物维生素C(0.0299mg/mL),咖啡因
(0.0598mg/mL),尼古丁(0.001 mg/mL),扑热息痛(0.2mg/mL),布洛芬(0.5mg/mL),利妥昔单抗(10mg/mL),水杨酸(0.000694mg/mL),在所示浓度时对本试剂不产生干扰。
6)包容性
采用92个已知特异性的样本进行研究,这些样本涵盖了常见的HLA I类抗体分子型。结果表明,本产品具有检测出常见的不同HLAI类抗体型别的能力。
7、HLA I类单抗原特异性抗体检测试剂盒的阳性判断值研究
对于给定的样本,产品会为血清中存在的HLA抗体确定MFI值,通过计算对MFI值进行标准化确定每个抗HLA反应的强度,并为手动分配反应评分提供依据。同样,采集的MFI值可以由软件进行标准化并分配反应评分。反应评分基于国际权威组织ASHI(美国组织相容性与免疫遗传学学会)的评分系统,该评分系统通过补体依赖性淋巴细胞毒性交叉配型试验(CDC)建立,使用细胞死亡百分比的分级量表来表示反应强度,评分1、2、4、6和8分别表示阴性、疑似阴性、弱阳性、阳性和强阳性。基于此,本产品推荐使用的阳性判断值为:评分为6和8时为阳性。
在验证研究中,采用了从经认证的HLA实验室收集的54个临床样本对本产品进行了评估。这些样本由多个实验室使用不同检测方式所得的测试结果汇编而来,因此可作为参考样本,其结果为共识结果。将本产品所检测结果与共识结果进行比较分析,匹配百分比为97%。
8、HLA I类单抗原特异性抗体检测试剂盒的稳定性研究
开发人对本产品在实际储存条件下保存至成品有效期后的实时稳定性、试剂开包装稳定性、运输稳定性等进行了系统的研究,确定了在各种条件下试剂的有效保存时间。所用试剂批次包括:008、009、010批。
实时稳定性研究:采用三批次试剂储存于-65°C或以下冷冻的条件,分别在0、6、13、17、24、35、42个月对HLA I类抗体阳性参考品,阴性参考品,HLA II类抗体阳性参考品进行检测,确定试剂在-65°C或以下冷冻的条件下,可稳定保存36个月。