今日头条
和黄Syk抑制剂ITP的Ⅲ期临床成功。和黄医药新型Syk抑制剂索乐匹尼布用于治疗成人原发免疫性血小板减少症 (ITP) 的中国关键III期研究(ESLIM-01)达到主要终点以及所有的次要终点。与安慰剂相比,接受索乐匹尼布治疗的患者的持续应答率具有临床意义和统计学意义的显著改善。详细数据将公布于学术会议上。和黄医药预计年底提交索乐匹尼布的新药上市申请。
国内药讯
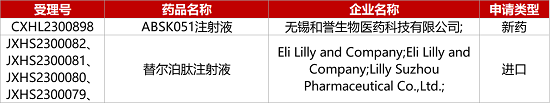
1.礼来GLP-1R/GIPR激动剂中国报减重NDA。礼来GLP-1R/GIPR双靶点激动剂替尔泊肽(Tirzepatide)注射液的上市申请获NMPA受理,用于减重适应症。今年2月,Tirzepatide已在中国肥胖或超重患者中开展的III期SURMOUNT-CN研究达到主要终点和所有关键次要终点。此前,该新药用于降糖适应症已在中国递交上市申请,目前正接受CDE监管审查。在美国,礼来已向FDA滚动提交减重适应症的上市申请。
2.创响OX40拮抗剂早期临床积极。创响生物OX40抗体新药IMG-007用于健康成年人的Ⅰ期单次递增剂量研究数据积极。结果显示,IMG-007具有良好的安全性,没有任何与治疗相关的不良事件报告;药物的终末半衰期均值为31天,并有潜力以每12周或更低频率给药。IMG-007可以特异性地结合OX40受体,并阻断OX40和OX40L之间的信号转导。该新药拟开发用于特应性皮炎等炎症和免疫疾病的治疗。
3.易慕峰自体CAR-T获胃癌孤儿药资格。易慕峰公司基于其合成性天然杀伤受体(SNR)技术平台研发的新一代自体CAR-T产品IMC008获得FDA孤儿药资格,用于治疗胃癌患者。SNR平台通过双重识别及功能加强机制,不仅能靶向特定抗原,还能通过SNR受体拓展CAR-T细胞的抗原识别范围,有效解决肿瘤抗原异质性所带来的挑战。在动物肿瘤模型中,IMC008已展现出良好的安全性和对异质性肿瘤的清除能力。
4.安济盛骨科创新药美国获批临床。安济盛生物首创新药AGA2115获FDA批准开展Ⅰ期临床,拟评估用于健康成年志愿者以及成骨不全症(OI)患者中的安全性、耐受性、药代动力学和药效学。临床前研究显示,AGA2115能通过显著的刺激成骨作用达到增加骨量、减少骨折发生并促进骨折愈合的效果。此前,FDA已授予该新药孤儿药资格和罕见儿科疾病认定。
5.科济药业与美德纳达成临床合作。科济药业靶向Claudin18.2的自体CAR-T产品CT041拟与美德纳Claudin18.2 mRNA癌症疫苗开展临床研究,评估联合用药治疗Claudin18.2阳性实体瘤的临床效果。科济拟开发CT041作为骨干疗法,用于治疗胃癌和胰腺癌。此前,该产品已分别获FDA和EMA授予的孤儿药资格,EMA授予的优先药物(PRIME)资格,以及FDA授予的再生医学先进疗法资格。
国际药讯
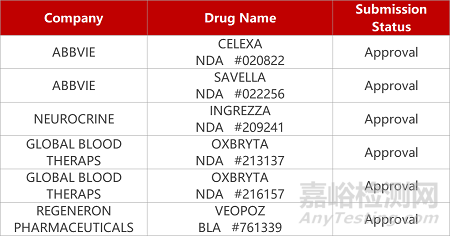
1.阿柏西普8mg长效制剂获批上市。再生元高剂量Eylea HD(8mg)得FDA批准上市,用于治疗湿性年龄相关性黄斑变性(wAMD)、糖尿病性黄斑水肿(DME)和糖尿病视网膜病变(DR)患者,给药周期最长达16周。在临床试验中,与8周一次Eylea(2mg)标准治疗组相比,每12周一次或每16周一次8mg阿柏西普给药组患者的视力改善达到非劣效性标准。Eylea(阿柏西普2mg)是一款VEGFR-Fc融合蛋白,已于2011年11月获FDA获批上市。
2.BI双机制减重疗法启动注册临床。勃林格殷格翰与Zealand开发的GLP-1/GCG双重激动剂BI 456906(Survodutide)将启动三项注册Ⅲ期临床,评估用于治疗超重或肥胖患者的疗效。今年6月,该新药针对减肥治疗的II期研究积极结果已公布于2023年美国糖尿病协会第83届大会上。数据显示,完成46周治疗的BI 456906(4.8mg)组患者体重下降接近19%;两个最高剂量组中患者体重下降至少20%的比例高达40%(安慰剂组为0%)。
3.强效PKC抑制剂上Ⅱ期临床。IDEAYA公司选择性PKC抑制剂darovasertib(IDE196),在单药用于原发性葡萄膜黑色素瘤(UM)患者的新辅助或辅助治疗的Ⅱ期临床首例患者给药。2023年4月,该新药已在Ⅰ/Ⅱ期临床中获得积极数据,darovasertib联合cMET抑制剂克唑替尼(crizotinib)的合成致死组合疗法用于初治转移性UM患者达到45%的客观缓解率(ORR)和90%的疾病控制率(DCR),而且药物耐受性良好。
4.现货型NK细胞疗法上Ⅰ期临床。Wugen公司同种异体记忆天然杀伤(NK)细胞疗法WU-NK-101在针对复发或难治性急性髓系白血病(AML)的首个人体临床试验中完成首例患者给药。该项试验拟评估WU-NK-101的耐受性、药代动力学、药效学、免疫原性和初步疗效,并确定Ⅱ期推荐剂量。WU-NK-101旨在利用记忆NK细胞的力量来治疗液体和实体肿瘤,FDA已授予该新药用于治疗AML的孤儿药资格。
5.儿童癌症药物公司引进VRK1抑制剂。Day One Biopharmaceuticals公司宣布与Sprint Bioscience就后者牛痘相关激酶1(VRK1)抑制剂达成全球独家许可协议和研究合作,以用于治疗高级别胶质瘤和高危神经母细胞瘤成人和儿童患者。VRK1的过度表达与预后不良有关,它已被确定为其旁系同源蛋白VRK2缺失型肿瘤的合成致死靶点。根据协议,Sprint Bioscience将获得300万美元的预付款,临床前研发费用,以及约3.13亿美元的里程碑后期付款。
6.Abcuro公司融资1.5亿美元开发KLRG1单抗。Abcuro公司宣布完成1.55亿美元B轮融资,用于开展靶向杀伤细胞凝集素样受体G1(KLRG1)单抗ABC008注册Ⅱ/Ⅲ期临床,评估用于治疗包涵体肌炎(IBM)的有效性与安全性。ABC008是一种潜在“first-in-class”KLRG1抗体,能够选择性地消灭高细胞毒性T细胞,同时保留幼稚T细胞、调节性T细胞和中枢记忆T细胞。此前,该新药已获得FDA和EMA授予用于治疗IBM的孤儿药资格。
医药热点
1.安徽省泛血管疾病管理中心联盟成立。8月18日,安徽省泛血管疾病管理中心联盟在合肥成立,旨在进一步整合安徽省内医疗机构泛血管疾病管理的优质资源,实现泛血管疾病领域优质资源的进一步共享,逐步构建国家、省、市、县四级泛血管疾病服务体系。未来,联盟的工作重心将着眼于推广泛血管疾病的规范治疗、优化基层泛血管疾病防治资源、加速泛血管疾病诊疗新技术转化落地。
2.南京中医药大学迎来两位新任领导。8月17日,江苏省委组织部在南京中医药大学宣布省委的任免决定,乔学斌同志任南京中医药大学党委书记,程纯同志不再担任南京中医药大学党委书记职务;程海波同志任南京中医药大学党委副书记、校长,胡刚同志不再担任南京中医药大学校长职务。根据公开信息,乔学斌,1970年7月生,汉族,江苏海安人,教授,研究员,博士生导师。2018年10月任南京中医药大学党委常委、副校长。现任南京中医药大学党委书记、副校长。
3.2023中国肥胖地图发布。8月17日,解放军总医院第一医学中心母义明教授团队在《糖尿病、肥胖与代谢》发表一项一篇题为《中国肥胖患病率及相关并发症:1580万成年人的横断面真实世界研究》的报告。报告数据显示:我国总体超重人群占比34.8%,肥胖人群占比14.1%;超重比例位列前三的省份为内蒙古(37.1%)、山东(37.1%)和河北(36.6%);男性中超重的比例为41.1%,而女性为27.7%。超重/肥胖参与者中最常见的并发症是脂肪肝、前驱糖尿病、血脂异常和高血压。
评审动态
1. CDE新药受理情况(08月21日)
2. FDA新药获批情况(北美08月18日)