随着纳米载体药物类型的不断增加,载体中包封药物的形式及游离药物的形式多样化,检测包封率的方法也趋于多样化。本篇就接触过的一些纳米载体药物类型,对载体中的包封药物形式、游离药物形式及包封率的检测方法做一个归纳,并对包封及游离存在形式的推断、证明、包封率方法的选择及自身工作中的一些问题做一个反思。
纳米载体药物类型(以结构划分)及相关结构:
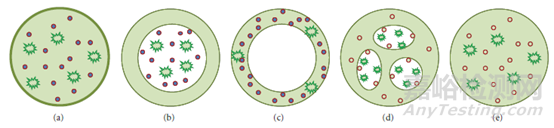
纳米载体药物的结构大体分为五种:
(a)、载体边缘形成一层薄薄的外壳,内部为实心填充物,药物溶解于内部的填充物或与之以共价键或其他形式结合。
(b)、载体外壳与内部填充物为不同的两相或内部无填充,药物溶解于内部填充物或与之结合或直接吸附于载体外壳的内表面。
(c)、载体外壳与内部填充物为不同的两相,药物溶解于外壳中或与之结合。
(d)、载体呈现多孔结构或多囊结构,药物吸附于孔隙中或溶解/结合于囊内填充物。
(e)、药物载体是由单个片段堆积而成,每个片段均携带一定的药物,片段与片段间通过键合或吸附作用形成一个单独整体,该结构不存在明确界限的外壳。(结构示意图详见图1)
图1 纳米载体药物结构类型[1]
载体中包封药物与游离药物的存在形式:
包封药物的存在形式与药物在填充物中的溶解度有一定关系。当填充物能够全部溶解药物时,药物大多以溶解状态存在;当填充物不能完全溶解药物时,部分药物以溶解状态存在,部分药物与填充物形成聚集体或者药物直接以晶体的形式嵌合在填充物内。游离药物的存在形式主要有两种:(1)药物直接溶解在载体外相,(2)药物以晶体的形式悬浮在载体外相中。
包封率检测方法汇总:
目前常用的包封率检测方法有:低速离心法、超速离心法、超滤离心法、葡聚糖凝胶柱法、微柱离心法、透析(反透析)法、絮凝离心法、鱼精蛋白凝聚法和固相萃取法等。其中超速离心法、超滤离心法是目前最常用的两种方法,葡聚糖凝胶柱法、微柱离心法和鱼精蛋白凝聚法常用于脂质体的包封率检测。
以上方法各有优缺点,针对不同的纳米载体药物类型和不同的包封药物、游离药物存在形式,有时候一种方法无法完全说明其分离的完全性,往往需要用其他方法加以佐证或用其他指标说明其适用性。下面就纳米载体药物结构剖析、包封及游离药物存在形式推断和包封率方法的选择做一个简单分析。
不同的辅料组成、不同的工艺导致了纳米载体药物的结构差异。首先对纳米载体药物的种类做一个大的划分:如现在市面上存在的脂质体、脂肪乳、胶束、微球、脂质纳米颗粒、白蛋白纳米颗粒、水凝胶等;其次对纳米载体药物的结构类型进行判断(如:脂质体和脂肪乳可能为上述的构型(b)或构型(c),多囊脂质体和微球可能为上述的构型(d),脂质纳米颗粒可能为上述的构型(a)),往往一种纳米载体药物中会存在一个或多个构型(普遍存在多个构型)。在上述基础上,需要对存在构型的基本特性(如载体外层的亲水亲脂性、载体是硬颗粒还是可变形颗粒、载体在配伍时的形态等)进行一次分析,这决定了包封率方法的初次粗筛结果(大多数硬颗粒载体可以通过低速离心法和超速离心法检测包封率)。接下来需要对包封及游离药物的存在形式进行推断,这需要从辅料的组成、药物的亲水亲脂性、载体内外相的辅料成分进行分析:(1)分析药物在各种辅料中的溶解情况,初步判断药物主要溶解在哪个辅料中;(2)各辅料中溶解药物的总量是否超过处方量,初步判断药物是否绝大部分以溶解状态存在;(3)主要溶解药物的辅料在载体中的哪一部分(外壳、内部填充物或载体外相);这其中存在一个问题:未溶解药物的存在形式该如何判断?就该问题,目前已经找到几种方法:1、显微观察,当未溶解药物以晶体的形式存在时,可明显观察到晶体的存在;2、小角度XRD,当未溶解药物以晶体形式嵌在载体内或以共聚物形式存在时,可明显观察到其与空白载体的差异;3、DSC,未溶解药物的存在会使得乳液的相变温度发生明显的改变。经过上述包封及游离药物存在形式的判断,对包封率方法进行二次初筛:当有药物晶体存在时,超速离心法、超滤离心法、絮凝离心法基本不适用,因其无法有效分离游离药物晶体与载体颗粒;当药物为全溶状态及可少量溶于水时,大多数方法均适用,固相萃取法不适用,因药物兼具亲水亲脂两种特性,无法选择非常合适的溶剂对固相萃取柱进行冲洗使包封与游离药物达到完全分离。在经过上述两次方法初筛后,基本确定分离包封与游离药物的方向。
对于具体的包封率方法选择,本文就盐酸多柔比星的两种不同构型载体(脂质体和PCL纳米颗粒)为例进行一个简单剖析。
盐酸多柔比星脂质体的关键辅料成分有氢化大豆磷脂酰胆碱(HSPC)、胆固醇、培化磷脂酰乙醇胺(MPEG-DSPE),这些成分共同形成脂质体的膜结构;盐酸多柔比星通过硫酸铵梯度法(主动载药)进入到空白脂质体的内水相,形成多柔比星硫酸盐[2]。盐酸多柔比星具有亲脂和亲水的双重特性,未包封于脂质体中的盐酸多柔比星溶解在外水相中。基于上述分析,可初步判断出两个不适用的包封率方法:1、低速离心法:由于游离药物溶解在外层水相中,脂质体颗粒的粒径较小,较低的离心力很难使其沉降,包封药物与游离药物无法有效分离。2、超速离心法:超高的离心力可以时脂质体颗粒沉降,但脂质体颗粒是柔性可变形颗粒,过高的离心力使得脂质体的完整性被破坏,内部包封的药物外泄,导致测得的包封率结果偏低。有文献报导可使用固相萃取法检测盐酸多柔比星脂质体的包封率及在血浆中的释放情况[3][4],对于该方法的论证,尽管文献中做了较多的分析,但尚缺少包封药物与未包封药物分离完全度的考量;在另一篇两性霉素B脂质体的包封率方法考察文献中[5],作者详细分析了C18填料和HLB填料固相萃取柱测定脂质体包封率的一些缺陷,两性霉素B脂质体同样使用了大豆磷脂和胆固醇,在用纯水进行洗脱时,可能由于填料与辅料之间的强相互作用,导致脂质体变得较难洗脱,同时在使用纯水进行洗脱时由于大量水的引入导致脂质体的外环境受到破坏,增加了脂质体破裂的风险。与两性霉素B不同的是,盐酸多柔比星溶于水,在使用纯水洗脱脂质体颗粒时,游离的药物会一同被洗脱下来。相对于固相萃取法而言,超滤离心法、鱼精蛋白凝聚离心法、葡聚糖凝胶柱法和微柱离心法测定盐酸多柔比星脂质体包封率的结果更可靠一些。
盐酸多柔比星PCL纳米颗粒与其脂质体有着较大的不同,PCL颗粒为硬质颗粒,相对而言具有更强的结构稳定性,大粒径的PCL颗粒更容易沉降,因此超速离心法测定包封率变得可行[6]。在文献[6]中,作者使用荧光标记法验证了超速离心法、超滤离心法和葡聚糖凝胶柱法检测包封率的准确性(以荧光标记的纳米颗粒载体的分离程度作判断),证实了超滤离心法对PCL纳米颗粒的截留最完全,最终判断超滤离心法检测PCL纳米颗粒的包封率结果更加准确。但是,该论证缺少两个重要的论点:1、荧光标记PCL纳米颗粒的完全程度,2、未包封药物分离的完全度。对于超速离心法,由于盐酸多柔比星溶解在外水相中,PCL纳米颗粒能否完全离心沉降是其验证的重点,而另一个需要考虑的是:超速离心后,外水相如何完全转移(即未包封药物分离的完全度)。由于超速离心后包封部分与未包封部分仍然在同一个体系中,离心后的溶液倾倒出上层可以将绝大部分未包封药物分离,但若要想达到完全分离,一是可以通过一次离心足够大的量让未包封药物的残留量能够忽略不计,二是可以通过反复清洗残渣并收集来达到完全分离。但总体而言,超速离心法只适用于大粒径PCL颗粒的包封率测试,且其相对于超滤离心法而言离心时间较长。对于超滤离心法,由于超滤膜的孔隙小,几乎所有的PCL纳米颗粒都可以被截留,但超滤膜对游离盐酸多柔比星的吸附会导致测得的包封率结果偏高,因此在实际操作过程中可以通过预先将超滤膜饱和化处理来提升结果的准确性;但随之出现的问题是由于超滤膜的饱和处理导致部分孔隙堵塞,使得分离时间变长、分离效率变差。
值得关注的是,在证明包封率方法的可行性时,除了多种检测方法的相互对比外,对游离药物及包封药物的表征也是较为关键的,好的表征手段可以极大的促进包封率的方法开发。除了文献[6]中提到的通过荧光标记纳米颗粒载体外,通过检测辅料在分离物中的分布情况也是一个较为实用的手段。
下面结合自身工作中碰到的一些问题对各包封率方法的优缺点进行一个简单分析。
低速离心法、超速离心法需要地耗材较少,操作相对简便,在实现不同粒径的硬质载体与游离药物的分离上有较大的优势。另外,脂肪乳中存在的游离晶体也适合用低速离心法进行分离,但分离完全度的判断一直是一个难题;如果脂肪乳中存在游离的晶体,这便意味着溶液的均一性受到挑战,取样量的选择及离心转速的选择会变成证明方法可行性的两个重点。对于不透明的液体纳米载体药物,低速离心法用于分离不溶性的游离药物更加难以证实其方法的准确性。对于超速离心法的应用,白蛋白纳米粒的包封率测定是较为成功的应用案例,这份成功建立在证明了药物的无定形状态和药物与白蛋白存在高结合率的基础上。对于可变形纳米载体,超速离心法会破坏载体的完整性从而导致包封率结果失真。
超滤离心法使用的超滤离心管成本相对较高,但包封率检测方法的优化(降低药物吸附及孔隙堵塞)可以增加超滤管的重复使用率。对于溶解在载体外相中的游离药物的分离,超滤离心法是较好的选择,但超滤膜吸附会导致包封率结果偏高、回收率偏低;对于分散在载体外相的游离药物晶体,超滤离心法无法将包封与游离部分进行有效分离;超滤膜吸附问题是超滤离心法的一大弊病。
微柱离心法所用的微柱成本相对较高,理论上可重复使用多次(因分离物质的性质而异);葡聚糖凝胶柱法与微柱离心法具有相似的分离效果,这两种方法的适用范围较广,既可以用作分离游离的的药物晶体,也可以根据体积排阻原理分离溶解型的游离药物;相对而言,微柱离心法具有更好的重现性。
絮凝离心法和鱼精蛋白凝聚法具有相同的分离作用,前者是向体系内加入絮凝剂使载体聚集,后者是利用鱼精蛋白的正电荷使带负电荷或中性的载体聚集。对于溶解型的游离药物,两种方法具有较好的分离作用;对于游离的药物晶体,两种方法均会因为载体凝聚包裹原本游离的药物晶体导致包封率结果偏高。絮凝剂/鱼精蛋白的用量、样品的加入量、载体凝聚的时间、如何完全分离聚集的载体和外相介质是这两种方法的考察重点。针对这两种方法,目前市面上存在一种下端可拆卸型离心管,用以解决分离聚集的载体和外相介质这一难题。
透析(反透析)法多见于体外释放中应用,在分离包封与游离药物时,需要考虑药物在透析介质中的溶解度、渗透速率、透析介质对载体的破坏性和纳米载体药物本身的稳定性。透析(反透析)法一般耗时较长,少则需要十多个小时,多则需要数天,这对纳米载体药物在实验条件下的稳定性是一个巨大挑战。反向透析法对纳米载体药物在透析介质中的稳定性挑战极大,因稀释倍数过高,原本的内环境被破坏。
固相萃取法常用的固相萃取柱填料为HLB(聚苯乙烯),固相萃取柱的成本较低,可重复使用多次,经过方法优化可获得极高的回收率和良好的重现性。对于分离多构型载体及多种存在形式的游离药物,固相萃取法具有较好的适用性。抛开固相萃取柱的内部填料,用于固定填料的筛板也会存在与超滤膜一样的吸附问题,但相对而言筛板的吸附量较少。
综上所述,包封率方法需根据纳米载体药物本身的性质进行选择。本文仅局限于作者本身阅历及实际工作经验进行了相应归纳,存在一定的缺陷,仅供参考。
参考文献:
[1] Like Zeng, Lingling An, and Xiaoyi Wu. Modeling Drug-Carrier Interaction in the Drug Release from Nanocarriers. Journal of Drug Delivery,2011
[2] 盐酸多柔比星脂质体注射液仿制药研究技术指导原则(试行),2020
[3] Eiichi Yamamotoa, Kenji Hyodoa, Naozumi Ohnishib, Takuya Suzukia, Hiroshi Ishiharaa.Direct, simultaneous measurement of liposome-encapsulated and released drugs in plasma by on-line SPE–SPE–HPLC.2011
[4] Yaping Xie, Nan Shao, Yi Jin, Liang Zhang, Huan Jiang.Determination of non-liposomal and liposomal doxorubicin in plasma by LC–MS/MS coupled with an effective solid phase extraction: In comparison with ultrafiltration technique and application to a pharmacokinetic study.2018
[5] Congcong Rana, Dan Chenb, Meng Xuc, Chaohui Dua.A study on characteristic of different sample pretreatment methods toevaluate the entrapment efficiency of liposomes.2016
[6] Yongjiu Lv, Haisheng He, Jianping Qi, Yi Lu, Weili Zhao.Visual validation of the measurement of entrapment efficiency of drug nanocarriers.2018