以下来自欧盟医疗器械协调小组(MDCG)2023年9月份发布的关于MDR附录XVI所涵盖的非预期医疗用途产品的过渡条款的问答。
【MDR关于非预期医疗用途产品的监管背景】
MDR法规自2021年5月26日起完全适用,其中也涵盖了没有医疗用途的产品(见附录XVI)。
MDR Annex XVI中非预期医疗用途产品目前包含以下六个产品组:
1) 隐形眼镜或其他引入眼睛或进入眼睛的产品,包括非处方彩色隐形眼镜。
2) 通过外科侵入手段全部或部分引入人体的产品,其目的是改变人体部位的解剖结构或固定,纹身产品和穿孔产品除外。
3) 用于面部或其他皮下、粘膜下或皮内注射或其他方式引入的物质,不包括用于纹身的物质,如真皮填充物。
4) 用于减少、移除或破坏脂肪组织的设备,如吸脂、脂解设备。
5) 用于人体的高强度电磁辐射(如红外线、可见光、紫外线)发射设备,例如,用于纹身或脱毛的激光和强脉冲光(IPL)设备。
6) 用于大脑刺激的设备,此类设备应用电流或磁场或电磁场穿透颅骨以改变大脑中的神经元活动。
欧盟委员会实施条例(EU)2022/2346(CS)规定了将风险管理应用于以上非医疗用途设备的通用规范,该条例自2023.06.22生效。
MDR中规定的过渡条款已由(EU)2022/2346相应延长,这个条例还规定了从这些延长的过渡期中受益的前提条件MDR中经修订的相关过渡条款自2023.03.20日起适用。大家注意使用最新版的MDR法规。
随后欧盟发布实施条例(EU)2023/1194,以使CS中列出的过渡条款与修订后的MDR中列出的条款保持一致。
1、 CS何时适用于非医疗用途产品?
从2023年6月22日起,CS适用于附录XVI 非医疗用途产品。
其中公告机构根据MDD发布的证书所涵盖的产品,其中某些规定从2022年12月22日起适用。
2、MDR何时开始适用于非医疗用途产品?
从2023年6月22日起,也就是CS的实施日期,MDR适用于附录XVI非医疗用途产品。
3、非医疗用途产品的过渡规定包括哪些?
MDR规定了6个月期限(2022-12-22~2023-06-22),来实施CS中规定的新的相关要求。
CS也制定了特定过渡条款,以缓解6个月过渡后仍不足以完全实施CS的新要求以及完成MDR下的适用程序的情况。这些情况包括:
1)公告机构需要参与符合性评估程序时,且制造商需要进行临床调查时;
2)根据MDR第120(2)条不再有效的非医疗用途产品的MDD证书。
对于根据MDR第120条第(2)款获得有效MDD证书的非医疗用途产品,MDR第120条第3、3a、3b、3c、3d和3e款中规定的过渡条款适用。
4、对于公告机构参与符合性评估且制造商决定进行临床调查的产品,CS中规定的过渡期是什么?需要满足哪些条件?
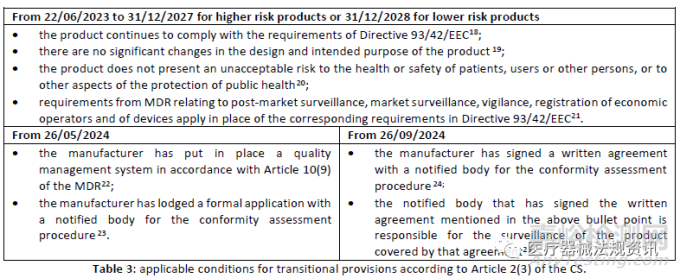
这个过渡期约为6.5年,从2023年6月22日到2029年12月31日。
过渡期内需要满足各种条件。有些是在整个期间,而另一些则是在特定日期内。下表显示了在过渡期内产品继续投放市场或投入使用需满足的条件。
5、对于公告机构参与符合性评估且制造商不打算进行临床调查的产品,CS中规定的过渡期是什么?需要满足哪些条件?
过渡期约为5.5年。它从2023年6月22日开始,到2028年12月31日结束。
在过渡时期,需要满足各种条件。有些是在整个期间,而另一些则是在特定日期内。下表显示了在过渡期内继续将产品投放市场或投入使用所需满足的条件。
6、MDD证书所涵盖的非医疗用途产品的MDR中规定的过渡期是什么?需要满足哪些条件?
高风险产品,即所有非WET类型的III类器械和IIb类植入类器械的期限于2027年12月31日结束,低风险产品(排除在高风险组之外的所有其他类别和器械)的期限至2028年12月30日结束。
注:WET器械,目前包括缝合线、吻合钉、补牙、牙套、牙冠、螺钉、楔块、板、线、针、夹子和连接器。
并非有MDD证书的所有产品都能受益于MDR过渡条款,需要符合以下条件才能受益于过渡条款:
a) 如果MDD证书从2017年5月25日起颁发,在2021年5月26日仍然有效,之后没有被撤销,并且在2023年3月20日之前失效,则只有满足第120(2)条第2段落a)或b)点中规定的条件之一,这类MDD证书上的产品才能受益于MDR过渡条款;
b) 如果MDD证书从2017年5月25日起颁发,在2021年5月26日仍然有效,之后没有被撤销,并且在2023年3月20日之前没有失效,则此类证书涵盖的产品可以从MDR过渡条款中受益。
MDR第120条第(3c)、(3d)和(3e)款规定了受益于并持续受益于过渡条款必须满足的附加条件和要求。关于这些具体条件的详细信息,请查阅关于实施条例(EU) 2023/607的问答文件。
7、MDD证书所涵盖的非医疗用途产品的CS中规定的过渡期是什么?需要满足哪些条件?
高风险非WET产品的过渡期约为4.5年,低风险产品的过渡期约为5.5年。从2023年6月22日开始,到2027年12月31日或2028年12月30日结束。
并非有MDD证书的所有产品都能从CS制定的过渡条款中受益。事实上,只有当MDD证书从2017年5月25日起颁发,在2021年5月26日仍然有效,之后没有撤销,在2023年3月20日之前到期,并且不满足第120条第2款第a)或b)点中描述的条件时,这些规定才适用。
在过渡期间,需要满足额外的条件和要求。下表列出了在过渡期内继续投放市场或投入使用产品所需满足的条件。
为了确定条件和要求,CS参考了MDR第120条第(3c)、(3d)和(3e)款。经法规(EU)2023/607修订的MDR过渡条款问答文件提供了其他有用信息。
8、在2023年6月22日之前,MDD证书所涵盖的非医疗用途产品的CS中规定的过渡期适用?需要满足哪些条件?
MDD证书所涵盖的非医疗用途产品的过渡期在CS中规定,之后由实施条例(EU)2023/1194对其进行了修订。这些过渡条款在2022年12月22日至2023年6月21日期间仍然适用。
在修订前,CS制定须符合的条件,以便受益及继续受益于过渡条文。这些条件包括产品需要继续符合MDD的要求,但在2021年5月26日后到期、仍有效MDD证书所涵盖的要求除外;需要避免产品的设计和预期用途发生重大变化;制造商需要与公告机构签署书面协议,以便进行适当的监督。经实施条例(EU)2023/1194修订的CS中保留了这些条件。
9、双重用途(dual-purpose)器械的过渡性规定是什么?
对于具有医疗和非医疗预期用途的双重用途器械,必须同时满足MDR和CS的适用要求。关于过渡条款,医疗用途需满足MDR第120条,非医疗用途需满足CS。器械同时满足MDR和CS的适用要求时,如果有些要求不同,应考虑并满足更严格的要求。
10、制造商如何证明他们的产品从过渡期中受益?
制造商应能够提供一份自我声明,确认符合从过渡条款中受益的条件,并说明过渡期的结束日期。
一旦新条件适用并得到满足,应立即更新自我声明。
自我声明应明确说明所涵盖的产品,并可基于统一的模板。
一旦与公告机构签署符合性评估书面协议的条件适用,则可以通过公告机构发布的“确认函”提供额外证据,说明收到制造商的符合性评估申请并达成书面协议。
11、在过渡期内,是否有必要向市场提供产品的最后期限?
不,没有必要提供。在过渡期内投放市场的产品也可以在过渡期结束后进一步流通。
12、在过渡期内,公告机构是否可以为MDR下的非医疗用途产品颁发证书?
是的,他们可以在过渡期内颁发非医疗用途产品MDR证书。公告机构可在2023年6月22日起的过渡期内为MDR下的附录XVI非医疗用途产品颁发证书。在此之前,MDR不适用于非医疗用途产品,因此公告机构无法为其颁发任何证书。