今日头条
海创AR靶向PROTAC国内获批临床。海创药业1类化药PROTAC药物HP518片获国家药监局临床默示许可,拟开发用于治疗“转移性去势抵抗性前列腺癌(mCRPC)”患者。HP518对野生型AR和恩扎卢胺耐药的变异AR具有高降解活性,并对AR依赖的前列腺癌的细胞系具有优异的抑癌活性。目前,该新药正在澳大利亚开展I期临床。今年年初,FDA已批准HP518在美国开展临床研究。
国内药讯
1.科伦博泰TROP2-ADC拟纳入优先审评。科伦博泰TROP2-ADC创新药SKB264获CDE拟纳入优先审评,用于既往至少接受过2种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者。值得一提的是,该新药此前已被CDE纳入三项突破性疗法认定:局部晚期或转移性三阴乳腺癌和EGFR-TKI治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌以及局部晚期或转移性HR+/HER2-乳腺癌。
2.艾棣维欣RSV疫苗II期研究见刊。艾棣维欣采用重组蛋白与新佐剂技术开发的呼吸道合胞病毒(RSV)疫苗ADV110,在澳大利亚健康老年受试者(60-80岁)中开展的II期临床积极结果发表于《medRxiv》上。接种ADV110疫苗后,所有组的抗原特异性抗体几何平均浓度(GMC)较免疫前基线水平均有所增加,且各组反应率均超过80%;不同剂量的ADV110疫苗均具有良好的耐受性,没有严重不良事件发生。
3.石药IL-17A单抗生物类似药获批临床。石药集团司库奇尤单抗生物类似药获国家药监局临床许可,拟开展用于治疗中重度斑块状银屑病患者的临床研究。司库奇尤单抗是诺华原研的一款白介素-17A(IL-17A)单抗药物,原研产品已在中国获批用于治疗斑块状银屑病和强直性脊柱炎。根据公开信息,司库奇尤单抗在中国的核心序列专利将于2025年到期。
4.第一三共CDH6-ADC中国报IND。第一三共开发的靶向CDH6的抗体偶联药物(R-DXd)DS-6000a的临床试验申请获CDE受理。在临床前研究中,R-DXd对表达CDH6的肾细胞癌和卵巢癌细胞表现出肿瘤生长抑制和肿瘤消退。公布于ESMO2023上最新Ⅰ期临床结果显示,DS-6000a在卵巢癌患者中ORR为46%,疾病控制率(DCR)达98%。目前,CDH6靶向药全球仅有两款ADC药物在研。
5.基石PD-1单抗授权三生制药。三生制药与基石药业就后者PD-1抗体nofazinlimab(CS1003)签署许可协议和生产技术转移协议,获得nofazinlimab在中国大陆地区包含开发、注册、生产、和商业化在内的独家权益。根据协议,基石药业将获得6000万元人民币首付款、近亿元人民币的研发及注册里程碑付款,以及产品的销售分成。目前,基石正在国际III期临床中评估nofazinlimab联合仑伐替尼一线治疗晚期肝细胞癌的效果。
国际药讯
1.K药联合化疗获批一线治疗胆道癌。默沙东PD-1抑制剂Keytruda获FDA批准新适应症,联合化疗(吉西他滨和顺铂)一线治疗局部晚期不可切除或转移性胆道癌(BTC)。在III期KEYNOTE-966研究中,与单独化疗相比,Keytruda联合治疗显著改善患者总生存期(12.7vs10.9个月;P=0.0034)。这也是keytruda在美国获得的第六项胃肠道癌症适应症。
2.诺华IL-17A单抗获批治疗化脓性汗腺炎。诺华制药IL-17A抑制剂司库奇尤单抗(secukinumab,商品名:Cosentyx)获FDA批准新适应症,用于治疗对常规疗法反应不足的活动性中重度化脓性汗腺炎(HS)患者。在III期研究(SUNSHINE和SUNRISE)中,与安慰剂相比,接受每两周一次Cosentyx 300mg治疗的患者在第16周获得临床反应(HiSCR)的比例显著更高。此前该新药已获批银屑病关节炎、放射学阴性中轴型脊柱关节炎等多项适应症。
3.首个CRISPR基因编辑疗法拟获批上市。近日,FDA细胞、组织和基因治疗咨询委员会针对Vertex公司与CRISPR公司开发的一次性、CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)用于治疗镰刀状细胞贫血病(SCD)患者的BLA申请进行讨论。咨询委员会认为,Vertex无需额外的临床试验以测试潜在的脱靶编辑,但建议对exa-cel进行长期的监测。在此前的临床试验中,所有31例接受exa-cel治疗的SCD患者在随访2.0~32.3个月期间,均未出现血管闭塞性危象。
4.阿斯利康TIGIT/PD1双抗上III期临床。阿斯利康TIGIT/PD1双抗Rilvegostomig在ClinicalTrials.gov上登记一项III期ARTEMIDE-Bil01临床,拟评估Rilvegostomig联合化疗用于胆道癌术后辅助治疗的有效性和安全性。该项研究计划入组750例受试者;预计2030年9月30日结束试验。在中国,该新药也在今年8月登记启动一项国际II期研究( GEMINI-Hepatobiliary),评估单药和联合用药治疗晚期肝胆管癌的潜力。
5.AZ拟2.5亿美元开发10项基因疗法。阿斯利康与Cellectis公司将利用后者专有基因编辑技术,合作开发多达10项的下一代细胞与基因疗法,应用于肿瘤和免疫学等领域。根据协议,Cellectis将获得2500万美元的预付款、潜在IND选择权费用,与开发、监管和销售里程碑款项;对于每一种候选产品,Cellectis将获得7000万至2.2亿美元的款项。阿斯利康将获得25个基因靶标的独家权利,以及多达10项候选基因疗法的选择权。
6.修美乐前三季度营收111亿美元。10月27日,艾伯维公布2023Q3业绩报告,三季度营收139.27亿美元,同比下降6.0%。前三季度主要产品的销售额:免疫领域TNF-α单抗修美乐(阿达木单抗)为111亿美元(-29.1%),IL-23单抗Skyrizi(瑞莎珠单抗)为53.69亿美元(+49.6%),JAK1抑制剂Rinvoq(乌帕替尼)为27.14亿美元(+54.9%);肿瘤领域BTK抑制剂Imbruvica(伊布替尼)为26.93亿美元(-22%),Bcl-2抑制剂Venclexta(维奈克拉)为16.99亿美元(+13.8%)。
医药热点
1.漳州将建两个省级区域医疗中心。近日,福建省卫健委、省发改委、省财政厅印发《福建省省级区域医疗中心项目扩容建设方案》,明确福建省将在现有4个省级区域医疗中心基础上,于2024年至2025年期间,依托3个市级公立综合医院和6个县级公立综合医院,再新建9个医疗中心。根据项目名单,漳州市医院将牵手北京协和医院、漳浦县医院将牵手福建医科大学附属协和医院,合作共建两个省级区域医疗中心,共同为漳州群众提供更加优质的医疗服务。
2.浙大附属邵逸夫医院新院区启用。近日,浙江大学医学院附属邵逸夫医院大运河院区顺利竣工备案,首期将于2023年12月正式启用。该项目总投资约19亿元,总占地面积75亩,总建筑面积21.4万方,可容纳1000张床位,主要包括急诊部、门诊部、住院部、行政管理用房等建设内容,投用后将成为大城北地区乃至辐射全市全省的公共医疗资源新高地。
3.国有医院划转中心医院,员工全部解聘。据央广网报道,湖南一家大型国有医院益阳康雅医院印发通知,称益阳市中心医院正与康雅医院进行资源整合,为顺利推进整合工作,市中心医院拟于近期正式接管康雅医院。鉴于此,医院将于11月30日和全体员工正式解除劳动或聘用协议。医院表示,将在市卫健委的指导下,积极配合市中心医院做好定向招聘工作,争取医院员工能留尽留、未被市中心医院聘用的人员,将依法依规支付经济补偿,并协助办理失业保险等相关手续。
评审动态
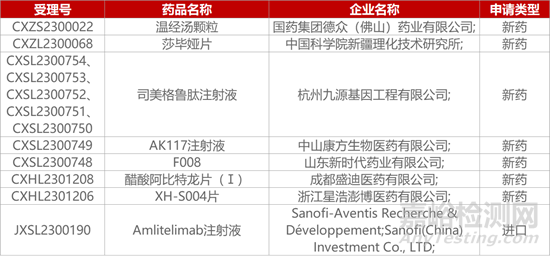
1. CDE新药受理情况(11月02日)
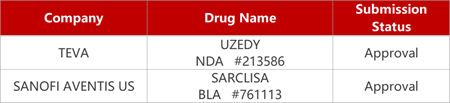
2. FDA新药获批情况(北美11月01日)