近年来,随着科技的发展,生物制药技术日新月异,技术的研究水平也上升到更高层次,并在整个行业中扮演着至关重要的角色,逐渐成为制药工艺中的中流砥柱,生物药工艺发展的强心剂。
为此,在2023年末之际,PharmaTEC制药业联合PHARMAC珐成浩鑫共同推出特别策划——《技术引领生物药商业化生产》专题,旨在为整个产业的高质量发展添砖加瓦。
此次专题内容汇集了很多来自生物制药行业的专家,分享对技术如何赋能生物药商业化生产的思考与见识,他们在不同领域的见地会给行业带来“鑫”突破。专题内容丰富,涵盖广泛,我们将陆续刊登专业文章与君共赏。
通常,技术转移是一项带有商业、监管、产品质量和技术风险的商业运作,其基本原则很简单,发起者将他们所有的专有技术转移给接收者,以实现产品生产、注册和商业化——由于种种原因,生物技术公司经常需要进行技术转移。对于一些公司来说,技术转移是生物制药产能风险管理的备份战略,可以为患者提供足够的药品供应;而对于另一些公司而言,由于其本身缺乏工艺优化、优化产品生命周期管理的能力和资源,因此需要进行技术转移,将技术转移到一个具有商业化生产能力的公司,以实现该生物药的商业化生产;还有一种情况是由于有了更大的批量生产及管理需求,公司想要扩大规模时也需要进行技术转移。目前生物制药技术转移也存在各种各样的问题和困难,本文将从生物制药技术转移的流程出发,简述目前生物制药存在的一些问题。
生物制药的原理是以基因工程为基础的现代生物工程,即利用现代生物技术对DNA进行切割、连接、改造,生产出传统制药技术难以获得的生物药品。通常生物药是通过活细胞或微生物培养产生,通过对细胞进行修饰,使其产生生物药中的活性物质。具体来说,生物药是指从生物体、生物组织、细胞、器官、体液等,综合利用微生物学、化学、生物化学、生物技术、药学等科学的原理和方法制造的一类用于预防、治疗和诊断的制品。
在生物制药行业,技术转移是指在开发和生产之间或生产站点之间的任何工艺及其文件和专业知识的转移,技术转移是产品生命周期中的重要组成部分,从药物开发、技术转移、商业化生产再到产品退市,技术转移相当于从药物研发到商业化生产的桥梁,保证研发的成果得到一个很好的实施,当然这期间有很多工作要做,包括工艺性能确认、工艺优化和提升等等,通常需要专业的技术团队来运作,成功的技术转移取决于整个项目转移一定要有一个强健的项目管理流程,同时团队对产品工艺有很好的理解,而且转出方需要与接收方保持紧密的合作。
技术转移的定义在PDA TR 65、ICH Q10、WHO技术指南中都有所描述,在药品技术转移方面的法规指南中,最早由WHO在第961号技术报告附件7《制药产品生产的技术转移指南》对技术转移进行了定义,并对技术转移的组织和管理,工艺、包装、清洁转移,分析方法转移,厂房设施和设备,文件,以及确认与验证等方面做了规定,对适用范围进行了强调,技术转移可出现在产品生命周期的各个阶段。2014年,美国PDA发布第65号技术报告《Technology Transfer》,从范围、过程、风险管理等角度对技术转移进行了解析,强调并举例说明了质量风险管理工具在技术转移过程中的应用。
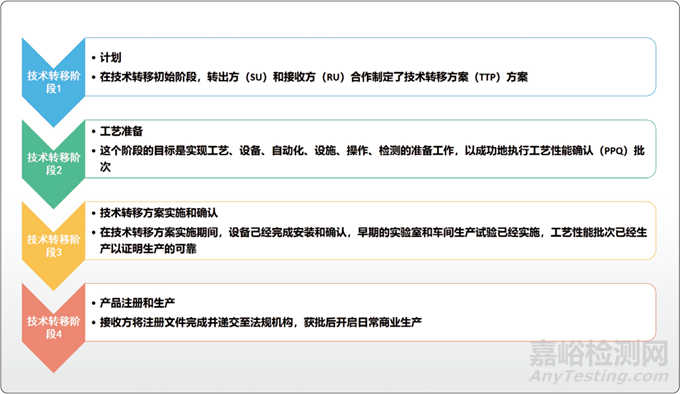
技术转移是一项复杂而耗时的工作,因为它涉及多个参与方和场地,一般生物制药的技术转移主要包括4个步骤,如图所示。
生物制药技术转移的4个步骤
因此,在技术转移开始之前,任何有关转移方的现有工艺和被转移方的设想工艺信息都必须先得到确认,通常生物制品技术转移会包括如图所示的4个阶段,在每个阶段中,每个部门都会遇到多种多样的问题,下文将分阶段对这些问题进行详细的论述。
一、技术转移阶段1:计划
在技术转移初始阶段,转出方(SU)和接收方(RU)合作制定了技术转移方案(TTP),这个方案会管理整个项目。技术转移方案的关键输入内容包括法规策略和差距分析(SU和RU的工艺、设备和厂房的比较;变更的风险评估;计划的风险降低措施)。
在计划阶段,技术转移的要求和限制、目的和目标、关键工艺指标(包括成功标准)必须被确定并同意。技术转移团队应该设计一个方案考虑到成本(包括材料和人员)、日程(包括被转移产品的供应)、范围、技术和质量。
在这个阶段,技术转移容易出现的问题和难点包括以下几点:
(1)接收方和转出方对于技术转移的组织架构不明确,双方责任不清晰,技术转移的流程没有完全达成一致或者没有讨论清楚,双方对于技术转移的理解有很多的不同,导致在技术转移的第一阶段就很难达成一致意见。例如,接收方和转出方的原辅料是否要完全保持一致,生物反应器的厂家和品牌是否可以不同,转出方的原始记录是否可以给接收方等等。
(2)接收方对于技术转移的范围定义不清晰,例如,不能明确本次技术转移的范围是否包括生物制品的包材,特别是直接接触产品的包材。很多接收方对于被转移产品的工艺、流程、分析方法、物料不够了解,导致没有对产品进行很好的理解和吸收;对于需要转移的范围没有完全确定,导致产品技术转移不完全。这些都对后期的技术转移带来了很大的困扰。例如,被转移的生物制品在无菌灌装时需要充氮保护,但是接收场地的灌装机却没有充氮保护的设备,这就会导致后面的生产出现问题。
(3)接收方对于技术转移方案的起草缺乏实际操作的经验。很多技术转移的方案是由接收方进行起草,在方案起草过程中接收方往往更关注需要把什么东西转入过来,但是却忽略了这个产品本身具有的特性要求,因此没有进行技术转移的要求。例如,有一些生物制品的无菌灌装由于容易出现蛋白的结晶颗粒,而不能使用柱塞泵进行灌装,而接收方在技术转移方案起草时并没有关注这个问题,使用了柱塞泵进行无菌灌装,结果导致生产出现偏差或失败。
(4)在技术转移方案中,有些转出方倾向于相信双方所有的设备仪器都能完全保持一致,但是在实际技术转移过程中很难做到双方完全保持一致,由于在技术转移方案中对于转出方和接收方的设备仪器的差距分析不完全,在接下来的生产过程中便会出现各种各样的问题。
二、技术转移阶段2:工艺准备
这个阶段的目标是实现工艺、设备、自动化、设施、操作、检测的准备工作,以成功地执行工艺性能确认(PPQ)批次。工程批生产积累的临时活动给所有系统提供了确认,都已经充分准备好执行工艺性能确认批次了,在接收方的培训是这个阶段的关键任务。
在这个阶段,技术转移容易出现的问题和难点包括以下几点:
(1)接收方在进行工艺性能确认前准备的过程中,对于接收的技术转移资料的理解不够充分和准确。例如,在细胞培养工艺中,有的接收方使用了现有的不锈钢生物反应器,但是转出方使用的是一次性生物反应器,双方搅拌方式不同,但是接收方还是按照转出方的搅拌速度进行了生产,结果发现细胞出现大面积的破碎,导致生产失败。
(2)接收方由于对自己工厂的设备和仪器非常熟悉,所以会先入为主地为接收的产品设计生产工艺流程和控制参数,这个时候往往忽略了对转出方生产设备和仪器的了解和分析,从而导致生产出现问题。例如,接收方使用的是可高温灭菌的、直接接触的pH计和电导率仪,但是转出方使用的是光电的pH计和电导率仪,由于两种仪表的工作原理不一样,测试结果有可能存在不同,结果导致了在接收方生产场地的细胞培养的失败。
(3)很多接收方在准备进行生产的过程中由于考虑到生物制品的生产成本比较高,很难进行多批次的试生产活动,往往对于是否进行工程批的生产都持有不同的意见,很多时候存在技术转移的时候不做工程批,直接进行GMP批次的生产,如果生产失败就把GMP批次改为工程批批次。这种方法存在偶然性,有时候第一次运气好,技术转移第一批次成功,就认定为GMP批次成功,但是在后面的GMP批次中却会出现不断的失败,造成这种现象的原因往往就在于对技术转移批次的研究不够充分,刚开始生产批次经验不足,就开始了GMP批次生产。
三、技术转移阶段3:技术转移方案实施和确认
在技术转移方案实施期间,设备已经完成安装和确认,早期的实验室和车间生产试验也已经实施,工艺性能批次已经生产,证明了生产的可靠性。
在这个阶段,技术转移容易出现的问题和难点包括以下几点:
(1)接收方按照技术转移方案进行工艺性能确认,但是发现工艺性能确认的结果与转出方提供的数据存在很大的差距。例如,生物制品的收率不同,可能转出方的细胞抗体表达量在7g/L左右,而接收方的细胞抗体表达量却在4g/L左右,这可能是由于接收方对于细胞培养的经验没有转出方充分,对于细胞的培养条件和控制参数不完全了解,甚至按照以前其他产品的思路来管理生产。
(2)接收方对于工艺性能确认的输入参数没能够仔细进行评估,很多参数是照搬技术转移方案。例如,层析过程中对于载量、流速完全按照技术转移方案进行实施,而忽略了层析的层高和直径的不同,导致抗体的杂质去除效果出现明显的不同。
四、技术转移阶段4:产品注册和生产
接收方将注册文件完成并递交至法规机构,获批后开启日常商业生产,这个阶段的事后评估是一个重要活动,是驱动技术转移业务过程的持续改进的方法,在前期阶段的风险顺序可根据风险控制的实施结果来修改。
在这个阶段,技术转移容易出现的问题和难点包括以下几点:
(1)接收方在递交申报资料的时候往往忽略了监管部门关心的“技术转移是否完全”,往往认为只要做出来,三批工艺性能确认时均合格,产品的检验结果是合格的就可以,忽略了技术转移后的生物制品的安全性和有效性是否能够得到有限保证。例如,有企业出现了技术转移后抗体的糖型分布比转出方要宽很多的问题,虽然都能够满足质量标准,但是临床效果有可能存在一定的区别。
(2)接收方的商业化生产的准备不足,很多接收方是研发公司,对于商业化生产的管理经验不足。例如,很多接收方在技术转移阶段做了很多的变更,这些变更会在注册阶段被监管机构进行审评和发补,由于接收方对这些变更的前期准备不足,会面临很多审评的问题,无法回答这些变化的原理以及有可能给产品的安全性、有效性带来的影响,导致产品迟迟不能批准。
五、 结 语
以上是生物制药技术转移存在的一些问题,可以看到在每个阶段都会出现不同的问题,因此建议企业需要在技术转移计划设计的时候就提前进行考虑,同时在技术转移和工艺验证时还应注意以下几点:
(1)设备的确认应当在工艺验证之前完成。清洁验证可以与工艺验证同时进行。无论转出方是否验证了该方法,接收方在工艺验证之前都需要验证分析方法。
(2)在接收方的验证活动开始之前,应当制定验证主计划以便于识别是否所有的工艺都需要被验证。
(3)在工艺验证开始之前应当完成工艺验证方案的批准。工艺验证方案应当包括特定的参数和测试,以便于监控和与可接受标准相比对。
(4)在接收方处成功完成商业化批量的验证并按要求完成了注册申报后,则可视为商业化生产工艺的成功转移。