您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-07-19 17:01
2024年7月11日,美国FDA发布了牙科复合树脂器械产品510(k)申请的指导文件草案:《Dental Composite Resin Devices - Premarket Notification (510(k)) Submissions》,目前正处于意见收集期。待本指南草案最终定稿后,将取代2005年10月26日发布的版本。
范围
本指南适用范围是产品代码为EBF的牙科贴片树脂材料以及产品代码为EBC的窝沟封闭剂材料。不包括用于其他用途的树脂修复体,如胶结、涂层、固定和临时修复的器械。本指南适用于属于组合产品的牙科复合树脂,但并不涉及组合产品特有的具体注意事项。
上市许可申请建议
A. 器械描述
应描述申报器械实现其预期用途的工作原理;器械组成部件的化学成分,包括所有聚合物、单体、引发剂、固化剂、稳定剂、增塑剂、洗脱剂、填料、着色剂及其他添加剂,以及这些物质按质量百分比的完整量化;随器械一起包装的配件的描述;器械的随附文件以及与器械一起使用或包装的任何器械配件的510(k)许可状态。
B. 与对比器械的比对
制造商须将其申报器械与类似的已合法上市器械进行比对,以证明实质性等同。并尽可能以列表的形式并排比较,可参考以下示例:
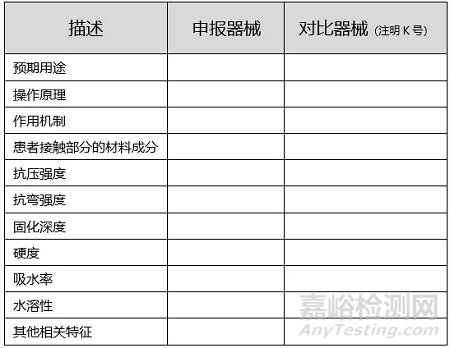
注:本表并非详尽参数清单,请确保提供所有相关的器械描述和性能特征。
C. 标识
上市前通知必须提供足以描述牙科复合树脂器械预期用途和使用说明的拟议标签和标识。FDA建议在使用说明书中包含以下信息:
● 抗压强度(MPa);
● 抗弯强度(MPa);
● 固化光强度(mW/cm2);
● 固化波长(nm);
● 固化深度 (mm);
● 所有树脂色调的固化时间(sec);
● 工作时间(sec);
● 固化时间(min);
● 与器械有关的其他属性。
D. 货架有效期
货架有效期测试应对器械的关键特性进行研究,以确保其在整个建议的货架期内性能充分且稳定。制造商应向FDA提交货架有效期测试所用的所有测试方法、结果和根据结果得出的结论摘要。若制造商采用加速老化的方式进行测试,则需对老化方式进行说明并提供理由解释基于加速老化的货架有效期测试结果如何代表器械实时老化的结果。对于老化测试,制造商可按照目前FDA认可版本的ASTM F 1980“Standard Guide for Accelerated Aging of Sterile Barrier Systems for Medical Devices”进行测试,并说明为达到货架有效期而设定的环境参数。
由于牙科复合树脂是由高分子材料组成,因此应对实时老化样品进行测试,以确认加速老化研究的结果。该测试应与 510(k) 审查和批准同时进行,并将结果记录在申报器械的设计历史文档中(即完整的测试报告无需提交给 FDA)。
E. 生物相容性
若申报器械在化学成分、制造和加工工艺上与具有安全使用历史的牙科复合树脂相同,则可参考以前的测试经验或文献;对于某些器械材料,也可提供公认的共识标准或器械主文件 (device Master File) 的授权书。若制造商无法获得与申报器械具有相同参数的对比器械,则可按照ISO 7405《牙科--牙科用医疗器械生物相容性评估》中的描述进行生物相容性评估。生物相容性评估应解释已确定的生物相容性风险、可用于降低已确定风险的信息以及任何仍存在的知识差距之间的关系。与此同时,制造商应确定为降低剩余风险而进行的生物相容性测试或其他评估,FDA建议生物相容性评估中应考虑以下终端:
● 细胞毒性;
● 致敏性;
● 刺激性或皮内反应;
● 急性全身毒性;
● 亚急性/亚曼性毒性;
● 遗传毒性。
F. 非临床性能测试
FDA建议对牙科复合树脂器械进行非临床性能测试,并且为每次的测试提供完整的测试报告,并附上测试结果摘要。制造商还应解释测试产生的数据如何支持器械实质性等同的结论。有关非临床性能测试报告的建议内容和格式信息,可参考指南“Recommended Content and Format of Non-Clinical Bench Performance Testing Information in Premarket Submissions”非临床性能测试主要从材料表征、物理和机械特性、固化光引发树脂所需能量、自固化树脂的工作和固化时间、X-射线不透性五个方面进行验证以证明非临床性能有效性。
材料表征:制造商应识别申报器械中所有化学物质的完整化学成分(即上文器械描述中提及的化学物质),且所有的化学物质应通过CAS号进行标识。颜色添加剂可参考21 CFR Part 73&Part 74中的CAS号或颜色索引编号进行识别。若申报器械中含有氟化物或其他洗脱剂,如钙、磷或硝酸根离子,则需量化这些物质随着时间推移的释放曲线。可提供具有代表性的器械样品在37℃、10ml蒸馏水中的离子累积释放浓度(离子μg/样品体积mm3)与时间(天数)的关系图。(累积释放浓度的计算方式:每天浓度测量值相加之和,共7天,且在测试期间应每天更换水。)
物理和机械特性:物理和机械特性测试可确保器械具有符合其预期用途的足够性能。对于申报器械的物理和机械特性测试方法应符合以下现行的FDA认可版本标准:
ISO 4049 Dentistry — Polymer-based restorative materials;
ISO 6874 Dentistry — Polymer-based pit and fissure sealants;
ISO 9917-2 Dentistry – Water-based cements – Part 2: Resin-modified cements。
且提供以下测试结果,确保申报器械具有足够的强度、刚度、硬度和水不溶性以满足其预期用途:
● 抗压强度(MPa);
● 抗弯强度(MPa);
● 弹性模量 (GPa);
● 表面硬度(KHN);
● 吸水率(μg/mm3);
● 水溶性(μg/mm3)。
若在性能声明中明确申报器械是“混合型”,即包括宏观和微观填料粒径,或“纳米填充”复合树脂,则还需提供填料粒径分布(μ),如器械中包含的填料粒径尺寸范围。
固化光引发树脂所需能量:固化光引发的牙科复合树脂所需的能量随器械中使用的引发剂类型、色调、填料类型、尺寸、负载和器械厚度的不同而变化。若牙科固化灯等外部能源提供的能量不足,将会导致牙科复合树脂器械固化不完全或过早失效。因此,确定光引发牙科复合树脂器械固化所需的能量有助于器械具有足够的特性,满足其预期用途。对于光引发牙科复合树脂,应使用目前FDA认可的ISO 4090版本中的方法提供以下性能测试结果,以表征固化牙科复合树脂器械所需的能量。除非另有规定,否则应在具有代表性或通用色调上进行测试。
● 固化的光强度(辐射出射度)(mW/cm2);
● 固化的波长(nm);
● 所有色调的固化时间(sec);
● 10秒正常模式下的固化深度(mm)。
自固化树脂的工作和固化时间:自固化牙科复合树脂是在治疗时混合和激活。在树脂开始硬化之前,牙科医生用来准备修复体的工作时间有限,修复体放置后,要等树脂凝固(即固化时间)后才能完全发挥作用。准确的工作时间和固化时间对于保证牙科医生有足够的时间放置修复体以及建议患者在修复体完全固化之前避免咀嚼修复后的牙齿至关重要。因此,对于自固化树脂,应提供工作时间(sec)和固化时间(min)的性能测试结果。
X-射线不透性:射线不透性是指牙科修复复合材料阻挡X射线传播的能力,透光率不足会影响牙科医生检测蛀牙、评估边缘和修复整体质量的能力。透光度可保证牙科复合树脂修复体在牙科X光片上清晰可见。制造商可使用目前FDA认可的ISO 4049版本中的方法对申报器械的射线不透性进行表征。
G.临床性能测试
FDA认为本指南所涉及的牙科复合器械属于非重大风险器械,通常不需要临床试验数据;但若需要任何关于器械的声明,如寿命、牙齿再矿化、减少腐烂或其他增强功能的临床结果时,则应提供临床数据。
若发生显著影响器械安全性和有效性的变更或修改时,或器械预期用途发生重大变更或修改,则需提交新的510(k)。

来源:苏大检测


