您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-02 09:34
一、前言
无定形固体分散体(amorphous solid dispersion, ASD)是指将药物以高能态的无定形高度分散于载体材料中形成的一种以固体形式存在的分散系统。在相同总浓度下,ASD产生的过饱和药物溶液相较于表面活性剂、环糊精等增溶手段具有更高的热力学活性,从而导致更高的跨膜通量。
药物从ASD中溶出后,可能会在胃肠道环境中达到相对于稳定晶型的饱和溶解度而言的更高的溶解度,这种现象被称为过饱和(supersaturation),而过饱和的实现可以增加药物的化学势(chemical potential),有利于难溶性药物通过被动扩散(passive diffusion)提高其肠道跨膜吸收,从而提高药物的口服生物利用度。
对于一个设计合理的ASD,在药物从ASD的溶出过程中,如果药物的浓度超过了其无定形溶解度(amorphous solubility)就会产生液-液相分离(Liquid-liquid phase separation, LLPS)现象,其显著特征是产生蓝色乳光(如图1所示)。目前已有众多研究表明,通过LLPS会形成富药纳米液滴(drug-rich nanodroplet),这种纳米液滴在体内可作为药物储库(reservoir),对于补充水相中经肠道被吸收的药物,维持药物的过饱和具有极其重要的意义,也是制剂研发人员在进行ASD的载药量、聚合物筛选等过程中需要着重考虑的。

图1 ASD溶出过程中的LLPS现象
二、相关概念介绍
2.1 无定形溶解度
药物的无定形溶解度(amorphous solubility)是指溶液相与药物的无定形形式之间达到平衡后溶液中的浓度。这种平衡只是暂时的,因为相较于药物的晶体溶解度而言,该系统是过饱和的,药物终将会从无定形转变为晶体,因而该平衡只是一种亚稳态平衡(metastable equilibrium)。
直接测量药物无定形溶解度具有一定的挑战性,因为即使通过熔融淬火、喷雾干燥或者其它方式获得了无定形药物,药物在溶液介质中很可能在达到平衡前就已经结晶。这种现象在快结晶药物(fast-crystallizer)中尤为明显。
目前较为简便快速的实验测量方法是紫外可见分光光度法(UV-vis extinction method)。该方法原理是将高浓度的药物溶液(溶剂通常为DMSO、甲醇或其它适合的溶剂)连续缓慢滴加到水性介质中,将检测波长设定在药物的不产生吸收的波长,在药物浓度达到无定形溶解度前光谱图几乎无变化,而当超过无定形溶解度时可以很容易地检测到由于新相形成而引起的光散射的突然增加,该突变点时的药物浓度即为其无定形溶解度(如图2所示)。
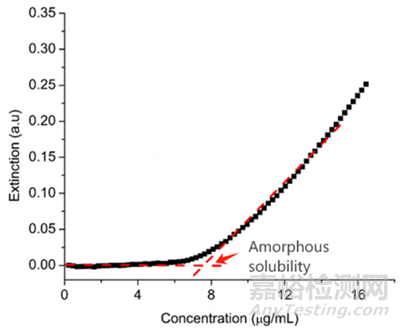
图2 UV-vis extinction法测定某药物的无定形溶解度
2.2 液-液相分离
我们可以通过图3来理解液-液相分离产生的机制,该图描述了药物(A)-水(B)组分在混合时系统的自由能变化(该部分理论性较强,理解起来有一定的难度,不感兴趣的读者可直接跳过)。
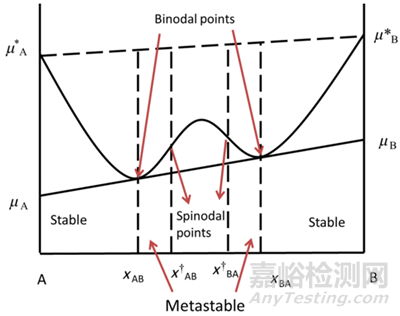
图3自由能对组成曲线
从图表右侧开始,即纯液态水(B)的状态,随着液态或无定形药物(A)的加入,混合自由能变得越来越负,这表明两种液体的混合在热力学上是有利的,直到达到组成xBA。同样地,如果从无定形药物(A)开始,随着水(B)的加入,混合自由能也会逐渐降低,直到达到组成xAB。这里,xAB和xBA分别代表了在药物-水体系中,药物和水的特定摩尔分数或浓度,使得混合自由能达到局部最小值或转折点,即图中的“双节点”(binodal ponits)。当药物-水体系的组成位于xAB和xBA之间时,即使混合自由能仍然是负的,但系统仍然可以通过自发地分裂成两个液相(一个接近xBA组成,另一个接近xAB组成)来进一步降低其总自由能。这种相分离过程是自发的,因为它符合热力学第二定律,即系统总是倾向于达到总自由能最低的状态。它们代表了相分离后每个相在平衡状态下所具有的组成。xAB是富药相,它主要由无定形药物组成,但含有少量混合在其中的水。相反,xBA是富水相,它主要由水组成,但溶解了少量的药物。在双节点之间的任何组成下,系统都会倾向于通过相分离成这两个具有不同组成的相来降低总自由能。
当药物-水体系处于旋节点(spinodal points)之间的区域时(图中x†AB和x†BA),均相溶液变得不稳定,微小的浓度波动会导致系统通过旋节分解(spinodal decomposition)过程自发地分裂成富药相和富水相,这种分离趋势是自发的,因为这样的变化能够降低系统的总自由能。液-液相分离(Liquid-liquid phase separation, LLPS)就是指一个原本均匀的液相自发地分裂成两个或多个具有不同组成和性质的液相的过程。在药物-水体系中,这通常表现为药物分子在局部区域聚集形成药物富集相,而水分子则在另一区域聚集形成水富集相。
旋节分解点决定了药物过饱和的上限,即药物无定形形式自发从溶液中相分离的点。双节点则通常被视为无定形溶解度。在双节点和旋节点之间的组成范围内,虽然存在相分离的热力学驱动力,但相分离可能不会立即发生,存在一定的时间滞后。然而,一旦超过旋节线分解点,相分离就会立即发生。
三、LLPS对于无定形固体分散体的重要意义
若药物在体内从ASD溶出过程中,若药物的浓度超过了其无定形溶解度,即可通过自发形成LLPS现象。LLPS导致溶液形成两个不同的液相,即富药相(drug-rich phase)和富水相(water-rich phase)。其中富药相富含药物,主要由药物组成的纳米液滴,而富水相则富含水且仅含有低浓度的药物,这两个相在热力学上是亚稳态的,且整个系统处于过饱和状态,它们之间保持着动态平衡。
当溶解在水相中的药物经肠道吸收,导致肠道内溶解的药物浓度降低时,通过LLPS形成富药纳米液滴中药物分子会迅速补充到水相中,这是因为富药纳米液滴作为一种无定形聚集体(粒径通常为几百个纳米),其小尺寸导致其具有储库效应。换句话说,由于无定形聚集体具有高表面积和预湿润状态,因此在无定形溶解度下饱和的溶液与无定形聚集体之间的平衡非常快,这有助于将溶解的药物浓度维持在无定形溶解度,使药物的膜渗透速率保持在理论最大值。由于无定形溶解度决定了药物在富水相中的最大可溶解浓度,且只存在于水相中的药物才能提供跨膜渗透的驱动力,因此通过被动扩散在肠道中的吸收受限于无定形溶解度。
对于上述内容,我们可以从以下几个方面进行剖析:
a.当药物在水性介质中的浓度超过其无定形溶解度时,系统会经LLPS,形成两个相:一个是连续相(即富水相),其药物浓度对应于无定形溶解度;另一个是分散相(即富药相),由纳米级的药物富集液滴组成。这些纳米液滴富含药物,形成了所谓的“药物富集相”。
b.这些纳米级的药物富集液滴被认为是一个“储库”,因为它们能够在药物从连续相中通过膜扩散后被快速补充。这意味着,即使连续相中的药物浓度随着跨膜运输而降低,药物富集相也能迅速重新平衡系统,保持较高的药物浓度梯度,从而维持较高的跨膜运输速率。
c.在没有LLPS的情况下,随着药物不断通过膜扩散,连续相中的药物浓度会逐渐降低,导致跨膜运输速率也随之下降。然而,药物富集相的存在使得系统能够维持一个相对稳定的、较高的药物浓度梯度,从而延长了高跨膜运输速率的持续时间。
因此,通过设计能够诱导LLPS的ASD给药系统,可以显著提高药物的生物利用度(图4),因为更多的药物能够以更快的速率通过胃肠道黏膜进入血液循环。另外还有一些研究表明,LLPS形成的富药纳米液滴可以够扩散通过非搅动水层(unstirred water layer, UWL)以及被小肠上皮细胞直接摄取等机制被吸收。
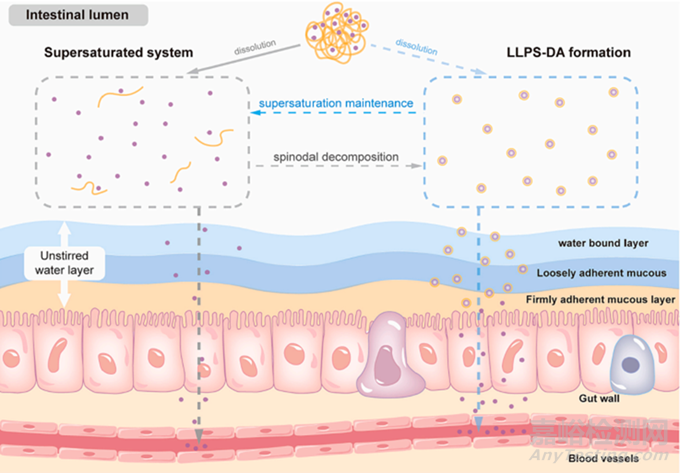
图4设计能够诱导LLPS的ASD给药系统可显著提高药物的生物利用度
四、案例分享
Indulkar等人通过UV-vis extinction法测定了难溶性药物克霉唑的无定形溶解度为7.5 μg/mL,而其晶体平衡溶解度仅为0.5μg/mL。随后,作者通过扩散池(flow-through diffusion cell)评估了药物通过膜的被动运输,具体而言是将不同浓度克霉唑溶液置于供体室,通过膜将药物扩散到受体室,并测量受体室中药物浓度的变化。
结果表明,当药物浓度低于无定形溶解度时,最大通量与初始浓度呈线性关系。然而,一旦浓度超过无定形溶解度,最大通量达到平台,且高通量持续的时间取决于供体室中药物丰富纳米液滴的数量(图5)。这证实了通过LLPS形成的纳米液滴起到了“储库”的作用,能够持续为跨膜运输补充药物,从而维持高通量。因此,LLPS可以显著增强和维持难溶性药物通过膜的被动运输速率,这为提高口服生物利用度提供了新的策略。
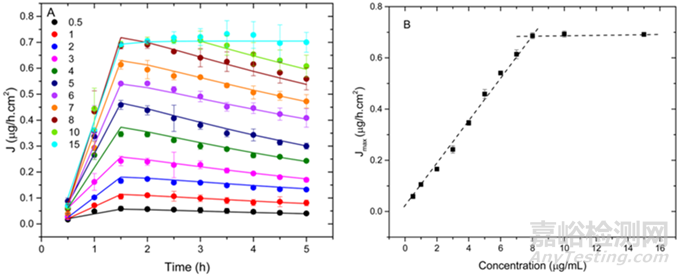
图5 供体室中不同浓度的克霉唑对应的通量曲线
参考文献
[1] Raina S A , Zhang G G Z , Alonzo D E ,et al.Enhancements and Limits in Drug Membrane Transport Using Supersaturated Solutions of Poorly Water Soluble Drugs[J].J Pharm, 2014, 103(9):2736-2748.
[2] Taylor L S , Zhang G G Z .Physical chemistry of supersaturated solutions and implications for oral absorption[J].Advanced Drug Delivery Reviews, 2016:122-142.
[3]Venecia,Wilson,Xiaochun,et al.Relationship between amorphous solid dispersion In Vivo absorption and In Vitro dissolution: phase behavior during dissolution, speciation, and membrane mass transport.[J].Journal of Controlled Release Official Journal of the Controlled Release Society, 2018.
[4] Indulkar A S , Gao Y , Raina S A ,et al.Exploiting the Phenomenon of Liquid-Liquid Phase Separation for Enhanced and Sustained Membrane Transport of a Poorly Water-Soluble Drug.[J].Mol Pharm, 2016:2059.
[5] Zhao P, Han W, Shu Y,et al.Liquid-liquid phase separation drug aggregate: Merit for oral delivery of amorphous solid dispersions.[J]. J Control Release. 2023 Jan;353:42-50.
[6] Yoshikawa Etsushi , Ueda Keisuke,Hakata Rei,et al. Quantitative Investigation of Intestinal Drug Absorption Enhancement by Drug-Rich Nanodroplets Generated via Liquid-Liquid Phase Separation. [J].Molecular pharmaceutics, 2024.

来源:药事纵横


